Tahukah Anda bahwa setiap senyawa kimia memiliki sifat dan karakteristik yang berbeda-beda? Suatu senyawa kimia merupakan gabungan antara kation dan anion, maka sifat dan karakteristik suatu senyawa pasti dipengaruhi oleh kation maupun anionnya. Kation dan anion yang membentuk suatu senyawa berasal dari unsur yang berbeda.
Misalnya reaksi yang terjadi antara unsur natrium dan klorida. Reaksi antara kation Na+ dan anion Cl- akan membentuk suatu garam yang disebut garam klorida (NaCl).
Senyawa tersebut tidak memiliki persamaan kimia, sehingga sifat dan karakteristiknya berbeda. Ahli kimia dapat mengetahui sifat-sifat unsur tersebut melalui pengelompokkan unsur berdasarkan kemiripan sifat, baik unsur maupun senyawanya. Pengelompokan tersebut ditampilkan dalam bentuk tabel sistem periodik unsur (SPU). Apa yang dimaksud dengan sistem periodik unsur? Bagaimana sifat unsur-unsur dalam tabel tersebut?
Pengertian Sistem Periodik
Sistem periodik unsur adalah suatu tabel yang berisi pengelompokan identitas unsur-unsur berdasarkan kemiripan sifatnya dalam bentuk periode dan golongan. Sejak jaman dahulu para ahli telah melakukan pengelompokan unsur-unsur, namun masih dalam bentuk yang sederhana.
Pengelompokan yang sederhana adalah dengan membagi unsur ke dalam kelompok logam dan nonlogam. Unsur yang termasuk ke dalam kelompok logam adalah besi, emas, perak, seng, nikel, dan tembaga.
Sedangkan unsur yang tergolong non logam adalah arsen, hidrogen, nitrogen, oksigen, karbon, belerang, dan fosfor. Seiring dengan perkembangannya, para ahli kimia semakin berupaya untuk mengelompokkan unsur-unsur dengan berbagai dasar pengelompokkan yang berbeda-beda.
Perkembangan Sistem Periodik Unsur
Beberapa unsur sudah sejak lama digunakan di beberapa bidang kehidupan manusia, salah satunya sebagai alat tukar dalam perdagangan atau perhiasan seperti tembaga, perak, dan emas.
Melalui hal tersebut, para ahli mulai mengetahui bahwa setiap unsur memiliki sifat dan karakteristik khas yang ditentukan oleh sifat atom-atomnya. Sampai saat ini telah ditemukan 115 jenis unsur dan masih akan ditemukan lagi unsur-unsur lainnya. Beberapa dari unsur ini memiliki kemiripan sifat dan ada pula yang berbeda.
Sistem periodik unsur ini didasarkan atas kenaikan nomor atom dan unsur dengan kemiripan sifat ditempatkan dalam satu golongan. Pengelompokan ini terus mengalami perkembangan dengan penjelasan sebagai berikut.
1. Sistem Periodik Antoine Lavoisier
Pada tahun 1789, Antoiner Lavoisier telah berhasil mengelompokkan 33 jenis unsur kimia berdasarkan sifat kimianya. Unsur-unsur tersebut dibagi menjadi empat kelompok yaitu gas, tanah, logam, dan non logam.
Unsur-unsur yang termasuk golongan gas adalah cahaya, kalor, oksigen, azote (nitrogen), dan hidrogen. Unsur-unsur yang tergolong nonlogam adalah sulfur, fosfor, karbon, radikal muriatik (asam klorida), radikal flourin (asam flourida), radikal boracid (asam borak). Unsur-unsur logam adalah antimon, perak, arsenik, bismuth, kobalt, tembaga, timah, besi, mangan, raksa, molibdenum, nikel, emas, platina, timbal, tungsten, dan seng.
Sedangkan unsur-unsur tanah adalah kapur, magnesia (magnesium oksida), barit (barium oksida), alumina (aluminium oksida), silika (silikon oksida). Keempat pengelompokan unsur ini masih terlalu umum karena dalam kelompok unsur logam masih terdapat berbagai unsur dengan sifat yang berbeda. Namun, 33 jenis unsur yang sudah dikelompokkan berdasarkan sifatnya ini dapat dijadikan referensi bagi ahli-ahli kimia selanjutnya.
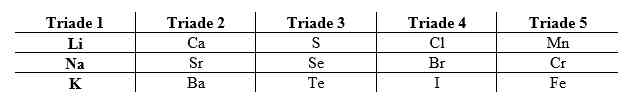
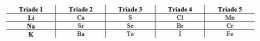
2. Sistem Periodik Traide Dobereiner
Johan Wolfgang Dobereiner pada tahun 1829 mempelajari sifat-sifat beberapa unsur dengan melihat adanya kemiripan sifat diantara beberapa unsur yang kemudian dikelompokkan menurut kemiripan sifatnya. Unsur-unsur tersebut dapat dikelompokkan menjadi tiga yang disebut triade.
Apabila dalam satu traide unsur-unsur tersebut disusun berdasarkan kemiripan sifatnya dan diurutkan berdasarkan massa atomnya, maka massa atom relatif merupakan rata-rata dari massa atom relatif unsur pertama dan ketiga.
Namun, terdapat beberapa unsur lain yang tidak termasuk ke dalam satu triade tetapi memiliki kemiripan sifat dengan traide tersebut sehingga pengelompokkan unsur ini kurang efisien.
3. Sistem Periodik Oktaf Newlands
Pada tahun 1863, John Alexander Reina Newlands yang merupakan seorang ahli kimia Inggris melakukan pengelompokan 62 jenis unsur berdasarkan kenaikan massa atom relatif melalui hukum oktaf. Hukum oktaf menyatakan bahwa, "Jika unsur-unsur disusun berdasarkan kenaikan nomor massa atom, sifat unsur tersebut akan berulang pada unsur kedelapan".
Sehingga unsur pertama memiliki kemiripan sifat dengan unsur kedelapan, begitu pula unsur kedua mirip dengan unsur kesembilan, dan seterusnya. Pengulangan ini diperkenalkan sebagai hukum oktaf karena Newlands melakukan perbandingan terhadap sifat unsur yang berulang ini dengan pola yang menyerupai tangga nada atau oktaf pada musik.
Namun hukum oktaf ini memiliki kelemahan dalam kenyataannya masih ada beberapa oktaf yang diisi lebih dari delapan unsur, sehingga pengulangan ini hanya cocok untuk unsur-unsur dengan massa atom yang kecil.

4. Sistem Periodik Unsur Mendeleev
Pada tahun 1869, Dmitri Ivanovich Mendeleev yang merupakan seorang sarjana asal Rusia melakukan pengamatan terhadap 63 unsur yang sudah dikenal pada saat itu dengan kesimpulan bahwa sifat-sifat suatu unsur merupakan fungsi periodik dari massa atom relatifnya dan persamaan sifat. Dalam kata lain, apabila penyusunan unsur berdasarkan kenaikan massa atom relatifnya, maka akan ada pengulangan sifat tertentu secara periodik.
Pada tahun 1871, tabel sistem periodik Mendeleev disempurnakan dengan menempatkan unsur-unsur yang mempunyai kemiripan sifat dalam satu lajur vertikal yang disebut golongan dan menempatkan unsur-unsur berdasarkan kenaikan atom relatifnya dalam satu lajur horizontal yang disebut periode. Mendeleev dianggap sebagai penemu pertama tabel sistem periodik yang sering disebut sistem periodik unsur pendek.
Keuntungan dari Tabel Periodik Mendeleev adalah sebagai berikut.
1) Tabel sistem periodik pertama yang disusun dalam bentuk delapan golongan dan tujuh periode.
2) Dalam satu golongan, sifat kimia dan sifat fisika berubah secara teratur.
3) Sifat unsur yang belum ditemukan dapat diramalkan dengan mengisi tempat kosong yang dikemudian hari diberi nama eka boron, eka aluminium, dan eka silikon.
4) Setelah penemuan unsur-unsur gas mulia, tabel ini tidak mengalami perubahan.
Kelemahan dari Tabel Periodik Mendeleev adalah sebagai berikut.
1) Apabila ditinjau dari bertambahnya massa atom relatif, ada beberapa urutan unsur yang terbalik.
2) Panjang periode tidak sama.
3) Dalam golongan VIII, dimasukkan triade besi (Fe, Co, dan Ni), triade platina ringan (Ru, Rh, dan Pd), dan triade platina (Os, Ir, dan Pt).
5. Sistem Periodik Unsur Modern
Henry G. J. Moseley pada tahun 1914 menemukan kesalahan dalam tabel periodik Mendeleev, yaitu unsur yang terbalik letaknya dan menemukan bahwa urutan unsur dalam tabel periodik sesuai dengan kenaikan nomor atom suatu unsur. Sistem periodik modern juga disebut sebagai sistem periodik bentuk panjang yang disusun berdasarkan kenaikan nomor atom dan kemiripan sifat. Sama seperti tabel periodik mendeleev, dalam sistem periodik modern terdapat periode dan golongan.
a. Penentuan Periode dalam Sistem Periodik Modern
Dalam sistem periodik, periode ditempatkan pada lajur horizontal atau lajur mendatar. Periode menunjukkan suatu nomor kulit yang berisi elektron (n terbesar) yang didasarkan atas konfigurasi elektronnya. Terdapat 7 periode dalam sistem periodik modern, yaitu:
- Periode 1 merupakan periode sangat pendek yang berisi 2 unsur
- Periode 2 merupakan periode pendek yang berisi 8 unsur
- Periode 3 merupakan periode pendek yang berisi 8 unsur
- Periode 4 merupakan periode panjang yang berisi 18 unsur
- Periode 5 merupakan periode panjang yang berisi 18 unsur
- Periode 6 merupakan periode sangat panjang yang berisi 32 unsur, dimana pada periode ini terdapat unsur Lantanida yaitu nomor 58 sampai sampai nomor 71 yang letaknya dibagian bawah
- Periode 6 merupakan periode belum lengkap yang berisi 24 unsur, dimana pada periode ini terdapat deretan unsur Aktinida yaitu nomor 90 sampai sampai nomor 103 yang letaknya dibagian bawah
b. Penentuan Golongan dalam Sistem Periodik Modern
Dalam sistem periodik, golongan ditempatkan pada lajur vertikal atau lajur tegak. Unsur-unsur segolongan adalah unsur yang ada dalam satu lajur tegak, terdapat delapan golongan utama golongan utama dan delapan golongan transisi. Unsur-unsur golongan utama yaitu:
- Golongan IA disebut sebagai golongan alkali
- Golongan IIA disebut sebagai golongan alkali tanah
- Golongan IIIA disebut sebagai golongan boron
- Golongan IVA disebut sebagai golongan karbon
- Golongan VA disebut sebagai golongan nitrogen
- Golongan VIA disebut sebagai golongan oksigen
- Golongan VIIA disebut sebagai golongan halogen
- Golongan VIIIA disebut sebagai golongan gas mulia
Pada periode 6 dan 7 terdapat masing-masing 14 unsur yang disebut unsur-unsur transisi dalam yang mempunyai kemiripan sifat yaitu unsur-unsur lantinida dan aktinida. Kedua unsur tersebut disebut unsur-unsur transisi dalam, dimana unsur-unsur lantinida pada periode 6 golongan IIIB, dan unsur-unsur aktinida pada periode 7 golongan IIIB.
c. Hubungan Konfigurasi Elektron dengan Sistem Periodik
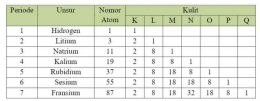
Penempatan unsur dalam suatu golongan atau periode didasari oleh konfigurasi elektron. Berikut merupakan tabel konfigurasi elektron pada unsur-unsur golongan IA.
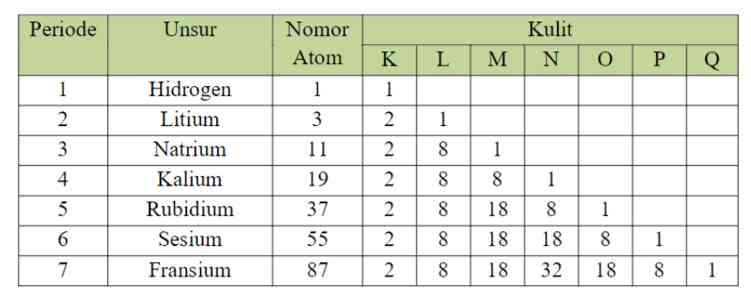
Berdasarkan tabel konfigurasi di atas, terdapat hubungan antara konfigurasi elektron dengan sistem periodik melalui nomor periode dan golongannya.
Jumlah Kulit = Nomor Periode
Jumlah elektron Valensi = nomor golongan
Hal tersebut juga berlaku untuk semua golongan utama kecuali Helium (He) yang posisinya terletak pada golongan VIIIA dengan elektron valensi 2. Sedangkan konfigurasi elektron untuk golongan transisi dilakukan per sub kulit karena hanya jumlah kulit yang sama dengan periode, namun jumlah elektron valensinya tidak sama dengan nomor golongan.
Penyusunan tabel sistem periodik didasarkan atas kemiripan sifat-sifat unsur. Sifat-sifat periodik unsur merupakan sifat-sifat yang dapat berubah secara beraturan sesuai dengan kenaikan nomor atom suatu unsur. Sifat-sifat tersebut meliputi, jari-jari atom, energi ionisasi, afinitas elektron, dan keelektronegatifan.
1) Jari-jari atom
Jari-jari atom adalah jarak antara inti atom dengan kulit terluar. Besarnya jari-jari atom dipengaruhi oleh jumlah kulit elektron dan muatan inti atom. Semakin banyak jumlah kulit elektron maka semakin panjang jari-jari atom dan apabila jumlah kulit atom sama banyak maka akan berpengaruh terhadap besarnya jari-jari atom yaitu muatan inti. Semakin banyak muatan inti atom, maka semakin besar gaya tarik inti atom terhadap elektronnya sehingga elektron akan lebih dekat dengan inti. Sehingga, semakin banyak muatan inti atom, maka semakin pendek jari-jarinya.
Dalam satu golongan, dari atas ke bawah jari-jari atom semakin besar yang karena jumlah kulit atom semakin bertambah. Dalam satu periode, dari kiri ke kanan jari-jari atomnya semakin kecil. Hal ini disebabkan karena unsur memiliki jumlah kulit yang sama dalam satu periode sedangkan jumlah elektron yang pada kulit dan proton pada inti atom bertambah. Sehingga menyebabkan terjadi gaya tarik menarik antara elektron dan proton yang semakin kuat sehingga jari-jari atomnya semakin kecil.
Energi ionisasi adalah energi minimum yang dibutuhkan suatu atom untuk melepaskan satu elektron terluar dalam fase gas. Energi ionisasi dapat dinyatakan dalam kJ mol-1. Semakin kecil energi ionisasi maka semakin mudah atom untuk melepaskan elektron. Sebaliknya, semakin besar energi ionisasi maka semakin sulit atom untuk melepaskan elektron. Besarnya nomor atom dan jari-jari atom dapat mempengaruhi harga energi ionisasi. Semakin besar jari-jari atom, maka semakin lemah gaya tarik inti terhadap elektron terluar. Hal tersebut berarti, elektron terluar akan lebih mudah lepas, sehingga energi yang dibutuhkan untuk melepaskan elektron terluar semakin kecil.
Dalam satu golongan, semakin ke bawah energi ionisasi semakin kecil, karena elektron terluar semakin jauh dari inti, sehingga elektron terluar semakin mudah untuk dilepaskan. Dalam satu periode, semakin ke kanan energi ionisasi semakin besar karena semakin ke kanan gaya tarik inti semakin kuat.
Afinitas elektron adalah besarnya energi yang dibutuhkan untuk menyertai proses pengikatan satu elektron pada satu atom netral dalam fase gas, sehingga terbentuk ion dengan muatan -1. Unsur dengan afinitas elektron bertanda negatif memiliki kecenderungan yang lebih besar untuk menyerap elektron daripada unsur dengan afinitas elektron bertanda positif. Semakin negatif nilai afinitas elektron, maka semakin besar kecenderungan suatu unsur untuk menyerap elektron atau kecenderungan untuk membentuk ion negatif.
Dalam satu periode dari kiri ke kanan, afinitas elektron cenderung bertambah besar karena jari-jari atom semakin kecil dan sehingga gaya tarik inti terhadap elektron semakin besar, dan semakin mudah atom untuk menarik elektron dari luar. Dalam satu golongan dari atas ke bawah, afinitas elektron cenderung berkurang karena jari-jari atom semakin besar, sehingga gaya tarik inti terhadap elektron semakin kecil, dan semakin sulit atom untuk menarik elektron dari luar.
4) Keelektronegatifan
Keelektronegatifan adalah kemampuan suatu atom untuk menarik elektron dari suatu atom dalam pembentukan ikatan kimia. Keelektronegatifan dapat diukur dengan menggunakan skala Pauling dengan besaran antara 0,7 sampai 4. Suatu unsur dengan harga keelektronegatifan yang besar cenderung menerima elektron dan akan membentuk ion negatif. Sedangkan unsur dengan harga keelektronegatifan kecil cenderung melepas elektron dan membentuk ion positif.
Dalam satu golongan, keelektronegatifan suatu unsur semakin kecil karena gaya tarik menarik inti semakin lemah. Dalam satu periode, keelektronegatifan suatu unsur semakin ke kanan akan semakin besar karena gaya tarik menarik inti semakin kuat. Perlu diingat bahwa golongan VIIIA tidak memiliki keelektronegatifan karena golongan VIIIA merupakan unsur-unsur golongan gas mulia yang sudah stabil dimana memiliki dua elektron valensi untuk He dan delapan elektron valensi untuk unsur-unsur yang lain. Sehingga keelektronegatifan terbesar pada setiap periode diperoleh oleh golongan VIIA yang termasuk unsur-unsur halogen.