c. Hubungan Konfigurasi Elektron dengan Sistem Periodik
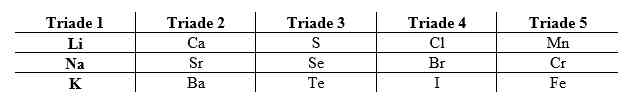
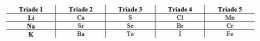
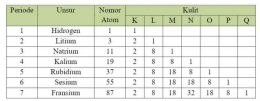
Penempatan unsur dalam suatu golongan atau periode didasari oleh konfigurasi elektron. Berikut merupakan tabel konfigurasi elektron pada unsur-unsur golongan IA.
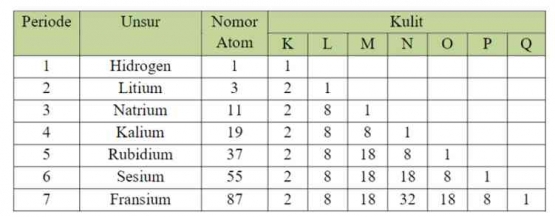
Berdasarkan tabel konfigurasi di atas, terdapat hubungan antara konfigurasi elektron dengan sistem periodik melalui nomor periode dan golongannya.
Jumlah Kulit = Nomor Periode
Jumlah elektron Valensi = nomor golongan
Hal tersebut juga berlaku untuk semua golongan utama kecuali Helium (He) yang posisinya terletak pada golongan VIIIA dengan elektron valensi 2. Sedangkan konfigurasi elektron untuk golongan transisi dilakukan per sub kulit karena hanya jumlah kulit yang sama dengan periode, namun jumlah elektron valensinya tidak sama dengan nomor golongan.
Penyusunan tabel sistem periodik didasarkan atas kemiripan sifat-sifat unsur. Sifat-sifat periodik unsur merupakan sifat-sifat yang dapat berubah secara beraturan sesuai dengan kenaikan nomor atom suatu unsur. Sifat-sifat tersebut meliputi, jari-jari atom, energi ionisasi, afinitas elektron, dan keelektronegatifan.
1) Jari-jari atom
Jari-jari atom adalah jarak antara inti atom dengan kulit terluar. Besarnya jari-jari atom dipengaruhi oleh jumlah kulit elektron dan muatan inti atom. Semakin banyak jumlah kulit elektron maka semakin panjang jari-jari atom dan apabila jumlah kulit atom sama banyak maka akan berpengaruh terhadap besarnya jari-jari atom yaitu muatan inti. Semakin banyak muatan inti atom, maka semakin besar gaya tarik inti atom terhadap elektronnya sehingga elektron akan lebih dekat dengan inti. Sehingga, semakin banyak muatan inti atom, maka semakin pendek jari-jarinya.