Pernahkan Anda melihat reaksi kimia yang menghasilkan warna-warna menarik? Tahukah Anda bahwa tidak semua zat kimia menghasilkan warna yang menarik? Warna yang menarik hanya dihasilkan oleh zat-zat yang memiliki konfigurasi elektron dan orbital atom tertentu. Jadi apa yang dimaksud dengan konfigurasi elektron?
Konfigurasi elektron merupakan gambaran distribusi elektron-elektron di antara berbagai orbital dalam atom atau molekul. Konfigurasi elektron dibagi menjadi dua, yaitu konfigurasi elektron berdasarkan kulit dan konfigurasi elektron berdasarkan subkulit.
1. Konfigurasi Elektron Berdasarkan Kulit
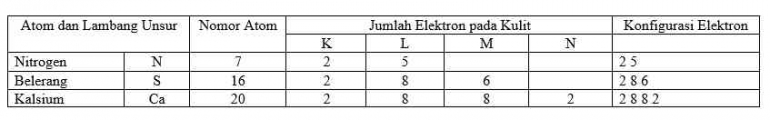
Menurut teori atom model Bohr, struktur atom digambarkan memiliki inti yang terdiri atas atom bermuatan positif yang disebut proton dan neutron, yang dikelilingi oleh elektron bermuatan negatif pada lintasan-lintasan tertentu berdasarkan tingkat energinya. Lintasan-lintasan tersebut disebut juga sebagai kulit atom. Setiap atom memiliki kapasitas maksimum untuk dapat ditempati oleh elektron. Semakin besar nomor kulit atom, maka semakin besar kapasitas atom untuk menampung elektron. Pengisian konfigurasi elektron berdasarkan kulit dimulai dari tingkat energi (kulit) yang paling rendah yaitu kulit K yang merupakan kulit pertama (n=1), kemudian dilanjutkan dengan kulit L yang merupakan kulit kedua (n=2) apabila kulit K sudah terisi penuh, dan seterusnya. Menurut Bohr, jumlah elektron maksimum yang dapat menempati setiap kulit atom dapat dihitung dengan menggunakan rumus.
Jumlah elektron maksimum = 2n, dimana n sebagai nomor kulit.
Kulit K (n=1) jumlah maksimal elektron yang ditampung 2. 1 = 2 elektron
Kulit L (n=2) jumlah maksimum elektron yang ditampung 2. 2 = 8 elektron
Kulit M (n=3) jumlah maksimum elektron yang ditampung 2. 3 = 16 elektron
Kulit N (n=4) jumlah maksimum elektron yang ditampung 2. 4 = 32 elektron
Kulit O (n=5) jumlah maksimum elektron yang ditampung 2. 5 = 50 elektron
Selain aturan jumlah maksimum elektron yang menempati setiap kulit atom, terdapat aturan lain yang menyatakan bahwa 8 elektron merupakan maksimum jumlah pada kulit terluar. Penulisan konfigurasi elektron dari suatu atom membutuhkan pengetahuan jumlah elektron melalui nomor atomnya.