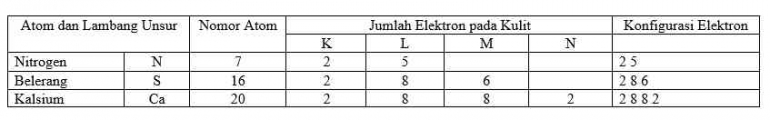
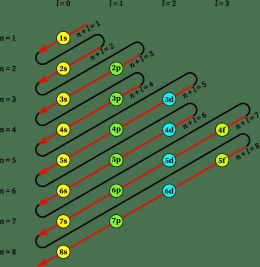
Pada gambar tersebut, anak panah menunjukkan urutan pengisian elektron. Pengisian orbital diawali dari orbital 1s, 2s, 2p, dan seterusnya. Ditunjukkan pula bahwa subkulit 3d memiliki energi yang lebih tinggi dari subkulit 4s. Sehingga, apabila 3p terisi penuh maka elektron berikutnya mengisi subkulit 4s, kemudian 3d.
2) Asas Larangan Pauli
Asas larangan Pauli digunakan untuk menentukan konfigurasi elektron pada atom yang berelektron banyak. Asas larangan Pauli menyatakan bahwa: "Tidak ada elektron-elektron dalam suatu atom yang memiliki keempat bilangan kuantum yang sama". Dengan kata lain, setiap orbital yang sama hanya ditempati oleh dua elektron dan kedua elektron berpasangan tersebut harus memiliki spin yang berbeda. Kedua elektron tersebut memiliki tiga bilangan yang sama dalam satu orbital, yaitu bilangan kuantum utama (n), bilangan kuantum azimuth (l), dan bilangan kuantum magnetik (m), sedangkan memiliki bilangan kuantum spinnya (s) berbeda. Hal tersebut bertujuan untuk mengimbangi adanya gaya tolak-menolak di antara elektron-elektron tersebut. Adapun batasan maksimum elektron yang dapat mengisi setiap sub kulit:
Subkulit s terdiri dari 1 orbital yang dapat diisi 2 elektron
Subkulit p terdiri dari 3 orbital yang dapat diisi 6 elektron
Subkulit d terdiri dari 5 orbital yang dapat diisi 10 elektron
Subkulit f terdiri dari 7 orbital yang dapat diisi 14 elektron
3) Asas Kaidah Hund
Untuk menggambarkan distribusi elektron-elektron pada orbital subkulit, pengisian konfigurasi elektron dapat ditulis dalam bentuk diagram orbital. Kaidah Hund menyatakan bahwa "Elektron-elektron pada orbital subkulit cenderung tidak berpasangan. Apabila pada subkulit sudah tidak ada lagi orbital kosong, maka elektron-elektron tersebut dapat berpasangan". Dalam kaidah Hund, sebuah strip dilambangkan sebagai orbital dan dua anak panah yang berlawanan arah dilambangkan sebagai elektron. Apabila di dalam suatu orbital hanya terisi satu elektron, maka posisi anak panah elektron menghadap ke atas.
4) Penyimpangan Konfigurasi Elektron
Penyimpangan konfigurasi elektron dalam pengisian elektron terjadi pada orbital subkulit d dan f. Penyimpangan pada orbital subkulit d disebabkan oleh orbital yang setengah penuh. Aturan setengah penuh ini menyatakan bahwa: "Suatu elektron dapat membentuk susunan elektron yang lebih stabil apabila memiliki kecenderungan untuk berpindah orbital". Dengan kata lain, orbital yang setengah penuh atau penuh akan lebih stabil dibandingkan dengan orbital yang hampir setengah penuh atau hampir penuh. Sehingga, apabila elektron terluar berakhir pada subkulit d yang hampir setengah penuh atau hamper penuh, maka satu atau semua elektron pada orbital s berpindah ke orbital d.