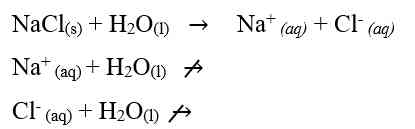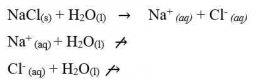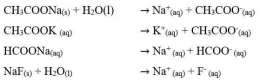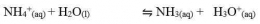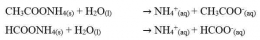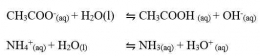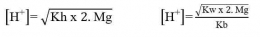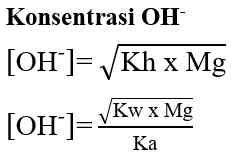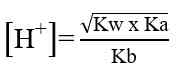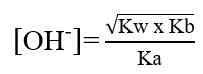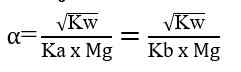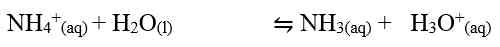
Adanya ion H+ dalam hasil reaksi menunjukkan bahwa larutan garam tersebut bersifat asam. Jika diuji keasamannya dengan menggunakan kertas lakmus biru, warna kertas lakmus akan berubah menjadi merah. Adapun ion Cl- dan Br- yang berasal dari asam kuat, tidak bereaksi dengan air (tidak terhidrolisis) sehingga terjadi hidrolisis parsial.
4. Garam yang berasal dari asam lemah dan basa lemah
Garam ini terionisasi di dalam air dan akan menghasilkan ion-ion. Kation dan anion keduanya berasal dari asam lemah dan basa lemah. Kedua ion tersebut mengalami hidrolisis sempurna. Perhatikan reaksi ionisasi CH3COONH4 dan HCOONH4 dalam air berikut.
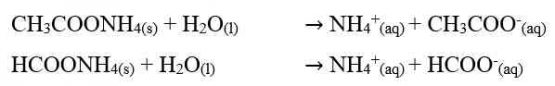
Perhatikan reaksi reaksi yang terjadi pada garam CH3COONH4
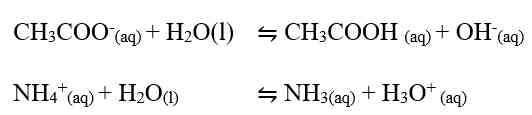
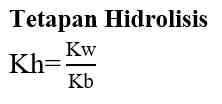
Pada hasil reaksi terdapat ion OH- dan ion H+. jadi, garam ini mugkin bersifat asam, basa, atau netral. Konsentrasi ion OH- atau ion H+ serta nilai pH yang dihasilkan sangat tergantung pada harga Ka dan Kb. Jika harga Ka lebih besar daripada Kb, ion H+ akan dihasilkan lebih banyak, dan sebaliknya jika Ka lebih kecil daripada Kb, maka ion H+ yang dihailkan lebih sedikit. Demikian juga dengan Kb, jika Kb yang dihasilkan lebih besar daripada Ka maka ion OH- yang dihasilkan banyak. Sebaliknya jika Kb lebih kecil dari Ka, ion OH- yang dihasilkan lebih sedikit. Hubungan antara Ka dan Kb adalah sebagai berikut.
- Jika harga Ka lebih besar daripada harga Kb, berarti konsentrasi ion H+ yang dihasilkan lebih banyak daripada konsentrasi OH- sehingga garam tersebut bersifat asam.
- Jika harga Ka lebih kecil daripada harga Kb, berarti konsentrasi ion H+ yang dihasilkan lebih sedikit daripada konsentrasi OH- sehingga garam tersebut bersifat basa.
- Jika harga Ka sama dengan harga Kb, berarti konsentrasi ion H+ dan ion OH- yang dihasilkan adalah sama sehingga garam tersebut bersifat netral.
Dari uraian tersebut, kita dapat mengetahui bahwa ion yang berasal dari asam atau basa lemah mengalami hidrolisis, sedangkan ion yang berasal dari asam kuat dan basa kuat tidak mengalami hidrolisis sehingga garam bersifat netral.
pH Larutan Garam
pH larutan garam dari asam dan basa kuat yang tepat habis bereaksi adalah pH = 7.