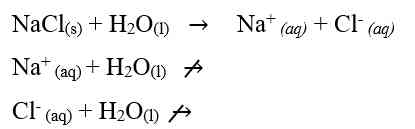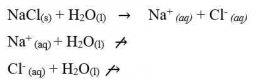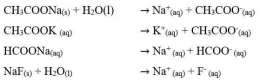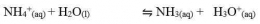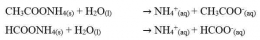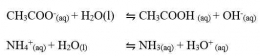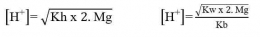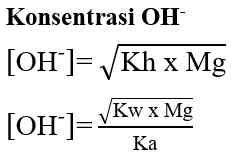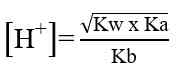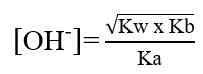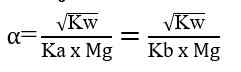Pernahkah Anda menggunakan garam dapur, soda kue dan pupuk ZA? Untuk apa bahan-bahan tersebut? Mungkin Anda menggunakan garam dapur untuk memberikan rasa asin pada makanan, soda kue untuk membuat adonan kue menjadi lebih mengembang dan pupuk ZA untuk menyuburkan tanaman.
Secara kimiawi Anda tentu sudah mengenal bahwa garam dapur, soda kue, dan pupuk ZA (Zwavelzure Ammoniak) adalah nama trivial, coba Anda telusuri bagaimana nama IUPAC nya? Berdasarkan nama IUPAC yang telah Anda telusuri, masih ingatkah Anda bagaimana rumus kimia dari bahan-bahan tersebut? Pada pembelajaran sebelumnya, Anda telah mempelajari tentang penggolongan senyawa, yakni: asam, basa, dan garam. Termasuk golongan senyawa manakah garam, soda kue dan pupuk Za? Seandainya Anda mengambil satu sendok pupuk ZA, (NH4)2SO4 kemudian Anda melarutkannya ke dalam air, apa yang terjadi? Apakah pupuk ZA larut? Apabila larutan diuji menggunakan kertas lakmus, maka perubahan apa yang terjadi pada kertas lakmus? Bagaimana sifat larutannya? Larutan senyawa garam jika diuji dengan menggunakan pH meter atau indikator universal menunjukkan pH larutan garam dengan kemungkinan yang berbeda-beda. Mengapa demikian? Untuk mempelajari lebih lanjut akan dikaji pada pokok bahasan Hidrolisis Garam.
Apabila larutan asam dicampur dengan larutan basa, maka secara spontan akan terjadi reaksi membentuk garam dan air.
Air terbentuk dari penggabungan ion H+ dari asam dan ion OH- dari basa. Karena air (H2O) bersifat netral, maka reaksi antara ion H+ dengan ion OH- disebut dengan reaksi penetralan. Sementara itu, kation dari asam selain OH- dan anion dari basa selain H+ akan membentuk garam.
Contoh:
HCl(aq) + NaOH(aq) --> NaCl(aq) + H2O(l)
Asam Basa Garam Air
Bagaimana dengan sifat garam yang terbentuk dari reaksi asam basa? Apakah semua garam yang terbentuk juga hanya bersifat netral? Faktanya ada garam yang bersifat asam, basa, maupun netral. Sifat senyawa asam dan basa dapat diidentifikasi dengan menggunakan indikator, salah satunya yaitu dengan menggunakan kertas lakmus. Untuk menjawab pertanyaan-pertanyaan tersebut, maka kita akan mempelajari tentang konsep hidrolisis garam.
Jenis-jenis Garam yang Terhidrolisis dalam Air
Sifat larutan garam dapat dijelaskan dengan konsep hidrolisis. Hidrolisis merupakan istilah yang umum digunakan untuk reaksi zat dengan air (hidrolisis berasal dari kata hydro yang berarti air dan lysis yang berarti peruraian). Menurut konsep ini komponen garam (kation dan anion) yang berasal dari asam lemah atau basa lemah bereaksi dengan air (terhidrolisis) membentuk H3O+ atau OH-. Hidrolisis kation menghasilkan ion H3O+ dan hidrolisis anion menghasilkan OH-.
Garam yang terhidrolisis di dalam air akan bersifat asam atau bersifat basa. Garam yang berasal dari reaksi asam kuat dan basa lemah akan menghasilkan ion H+ dan bersifat asam, sedangkan garam yang berasal dari reaksi basa kuat dan asam lemah akan menghasilkan ion OH- dan bersifat basa. Untuk mengetahui apakah suatu garam bersifat asam, basa atau netral dapat dilakukan analisis menggunakan kertas lakmus. Jika garam tersebut bersifat asam (memerahkan kertas lakmus) atau bersifat basa (membirukan kertas lakmus). Garam yang bersifat netral (tidak mengubah warna kertas lakmus). Secara umum garam dibedakan menjadi 3 yaitu:
1. Garam yang tidak terhidrolisis
Garam yang berasal dari asam kuat dan basa kuat tidak mengalami hidrolisis dan bersifat netral.
2. Garam yang terhidrolisis sebagian
Garam yang terhidrolisis sebagian ini biasanya terbentuk dari reaksi antara asam kuat dan basa lemah atau basa kuat dan asam lemah. Garam-garam ini biasanya bersifat asam atau basa.
3. Garam yang terhidrolisis sempurna
Garam yang terhidrolisis sempurna ini biasanya terbentuk dari reaksi antara asam lemah dan basa lemah. Garam-garam ini biasanya bersifat asam atau basa.
Reaksi Hidrolisis
1. Garam yang Berasal dari Asam Kuat dan Basa Kuat
Garam yang berasal dari dari asam kuat dan basa kuat tidak terhidrolisis. Hal ini dikarenakan ion-ion yang berasal dari asam kuat dan basa kuat tersebut tidak memiliki kecenderungan untuk membentuk asam atau basa asalnya. Sehingga garam yang berasal dari asam kuat dan basa kuat ini terionisasi sempurna dalam air. Sebagai contoh jika melarutkan NaCl murni dalam air, maka NaCl akan terionisasi sempuran menjadi Na+ dan Cl-. Persamaan reaksinya adalah:
Karena ion Na+ dan Cl- bersifat stabil di dalam air maka tidak terjadi reaksi dengan air karena masing-masing berasal dari asam kuat dan basa kuat, jadi melarutnya garam ini tidak merubah konsentarsi ion H+ dan ion OH-. Sehingga garam dengan tipe ini, pH-nya sama dengan pH air yaitu 7 (larutan bersifat netral).
2. Garam yang Berasal dari Asam Lemah dan Basa Kuat
Garam ini akan terionisasi sempurna dalam air dan akan menghasilkan ion-ion. Anion berasal dari asam lemah dan kation berasal dari basa kuat. Perhatikan reaksi-reaksi berikut.

Anion dari asam lemah CH3COO-, HCOO-, dan F- akan bereaksi dengan air (terhidrolisis) sesuai dengan persamaan reaksi berikut.

Ingat kembali sifat-sifat asam-basa Bronsted-Lowry. Basa konjugasi dari asam lemah merupakan basa yang relatif kuat dibandingkan basa konjugasi dari asam kuat sehingga dapat bereaksi dengan air. Adanya ion OH- dalam hasil reaksi menunjukkan bahwa larutan garam tersebut bersifat basa. Jika diuji dengan kertas lakmus merah, warna kertas lakmus akan berubah menjadi biru. Ion K+ dan Na+ yang berasal dari basa kuat tidak bereaksi dengan air, artinya tidak mengalami hidrolisis. Hidrolisis yang terjadi pada anion saja atau pada kation saja disebut hidrolisis parsial (hidrolisis sebagian). Jadi, garam jenis ini mengalami hidrolisis parsial.
3. Garam yang berasal dari Basa Lemah dan Asam Kuat
Garam ini akan terionisasi sempurna dalam air dan akan menghasilkan ion-ion. Kation berasal dari basa lemah dan anion berasal dari asam kuat. Perhatikan reaksi-reaksi hidrolisis berikut.

Kation dari basa lemah (NH4+) akan terhidrolisis dengan reaksi sebagai berikut.

Adanya ion H+ dalam hasil reaksi menunjukkan bahwa larutan garam tersebut bersifat asam. Jika diuji keasamannya dengan menggunakan kertas lakmus biru, warna kertas lakmus akan berubah menjadi merah. Adapun ion Cl- dan Br- yang berasal dari asam kuat, tidak bereaksi dengan air (tidak terhidrolisis) sehingga terjadi hidrolisis parsial.
4. Garam yang berasal dari asam lemah dan basa lemah
Garam ini terionisasi di dalam air dan akan menghasilkan ion-ion. Kation dan anion keduanya berasal dari asam lemah dan basa lemah. Kedua ion tersebut mengalami hidrolisis sempurna. Perhatikan reaksi ionisasi CH3COONH4 dan HCOONH4 dalam air berikut.

Perhatikan reaksi reaksi yang terjadi pada garam CH3COONH4

Pada hasil reaksi terdapat ion OH- dan ion H+. jadi, garam ini mugkin bersifat asam, basa, atau netral. Konsentrasi ion OH- atau ion H+ serta nilai pH yang dihasilkan sangat tergantung pada harga Ka dan Kb. Jika harga Ka lebih besar daripada Kb, ion H+ akan dihasilkan lebih banyak, dan sebaliknya jika Ka lebih kecil daripada Kb, maka ion H+ yang dihailkan lebih sedikit. Demikian juga dengan Kb, jika Kb yang dihasilkan lebih besar daripada Ka maka ion OH- yang dihasilkan banyak. Sebaliknya jika Kb lebih kecil dari Ka, ion OH- yang dihasilkan lebih sedikit. Hubungan antara Ka dan Kb adalah sebagai berikut.
- Jika harga Ka lebih besar daripada harga Kb, berarti konsentrasi ion H+ yang dihasilkan lebih banyak daripada konsentrasi OH- sehingga garam tersebut bersifat asam.
- Jika harga Ka lebih kecil daripada harga Kb, berarti konsentrasi ion H+ yang dihasilkan lebih sedikit daripada konsentrasi OH- sehingga garam tersebut bersifat basa.
- Jika harga Ka sama dengan harga Kb, berarti konsentrasi ion H+ dan ion OH- yang dihasilkan adalah sama sehingga garam tersebut bersifat netral.
Dari uraian tersebut, kita dapat mengetahui bahwa ion yang berasal dari asam atau basa lemah mengalami hidrolisis, sedangkan ion yang berasal dari asam kuat dan basa kuat tidak mengalami hidrolisis sehingga garam bersifat netral.
pH Larutan Garam
pH larutan garam dari asam dan basa kuat yang tepat habis bereaksi adalah pH = 7.
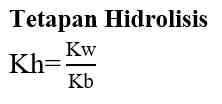
pH larutan garam dari asam dan basa bukan kuat dihitung dengan tetapan hidrolisis (Kh), dan tetapan ionisasi asam dan basa (Ka dan Kb).
Garam dari asam kuat dan basa lemah bersifat asam atau pH < 7.


Apabila garam berasal dari kation atau anion yang salah satunya bervalensi dua, maka

Garam dari basa kuat dan asam lemah bersifat basa atau pH > 7


Apabila garam berasal dari kation atau anion yang salah satunya bervalensi dua, maka:

Garam dari asam lemah dan basa lemah
Jika Ka sama dengan Kb maka garam bersifat netral atau pH = 7
Jika Ka > Kb maka garam bersifat asam atau pH<7

Jika Kb > Ka maka garam bersifat basa atau pH > 7

Derajat hidrolisis merupakan derajat yang menunjukkan tingkat kesempurnaan hidrolisis