Memperoleh vaksin merupakan bentuk bagaimana negara menjamin hak asasi manusia dalam bentuk hak atas kesehatan, akan tetapi apakah ini berlaku apabila vaksin yang diberikan masih dalam tahap uji coba?
Indonesia menduduki peringkat ke-2 populasi TB terbanyak di dunia. Per tahun 2023, diperkirakan 1,25 juta orang meninggal akibat TB serta 10 juta orang menderita penyakit TB. Indonesia berkontribusi 10 persen terhadap angka penderita TB dunia (WHO, Global TB Report 2024). Sementara di Indonesia, angka kematian (mortalitas) akibat TB telah mencapai 125.000 orang, jumlah kasus (morbiditas) 1.090.000 per tahunnya (Kemenkes, Laporan Penanggulangan Tuberkulosis 2023).
Melihat perkembangan kasus TB di Indonesia, dibutuhkan solusi yang tidak hanya bersifat kuratif (mengobati) tapi juga preventif (mencegah). Bill Gates, pendiri Microsoft dan filantropi asal Amerika Serikat pun hadir menawarkan solusi dengan menjadikan Indonesia sebagai salah satu negara uji coba Vaksin TBC yang disponsori oleh The Gates Foundation. Program uji klinik vaksin M72 menjadi perbincangan setelah pertemuan Bill Gates dengan Presiden Prabowo Subianto di Jakarta pada Mei 2025 lalu.
Apakah hadirnya uji klinik vaksin TBC ini merupakan solusi harapan yang selama ini dibutuhkan oleh masyarakat Indonesia agar bebas dari TB, atau justru merupakan peluang eksploitasi perusahaan besar Amerika Serikat untuk memanfaatkan kerentanan populasi penderita TB untuk mengumpulkan data dan mengembangkan vaksin TBC yang akhirnya berakhir akan menjadi suatu produk komersil? Apakah rakyat Indonesia justru tidak akan berakhir sebagai “kelinci percobaan” uji coba vaksin yang belum terjamin keamanan dan efektivitasnya?
Mengapa Indonesia?
Sebenarnya dokter dan praktisi medis di Indonesia sudah sejak lama menggunakan vaksin TBC. Vaksin Bacillus Calmette-Guérin (BCG) merupakan vaksin TB yang telah masuk ke dalam program imunisasi wajib di Indonesia. Vaksin BCG telah direkomendasikan oleh Kementerian Kesehatan dan Ikatan Dokter Anak Indonesia (IDAI), masuk dalam jadwal imunisasi dasar lengkap dan wajib diberikan satu kali pada bayi baru lahir atau paling lambat sebelum bayi tersebut berusia 1 bulan.

Menjadi penting untuk diketahui adalah apa sebenarnya perbedaan vaskin BCG yang telah lama digunakan dan familiar dengan masyarakat ini dengan vaksin M72 yang masih dalam tahap uji klinik? Ketua Majelis Kehormatan Perhimpunan Dokter Paru Indonesia (PDPI), Tjandra Yoga Aditama mengungkapkan tiga perbedaan vaksin BCG dengan vaksin M72, yaitu:
- Vaksin BCG sudah ditemukan sejak 1921 membuat usia vaksin ini sudah berumur 104 tahun.
- Vaksin BCG ini hanya diberikan pada anak-anak atau bayi baru lahir sehingga vaksin ini hanya bisa memberikan proteksi sebagian untuk anak dan tidak memberikan jaminan perlindungan untuk penyakit TB pada orang dewasa.
- Vaksin baru dibutuhkan untuk mengejar pencapaian target pengentasan tuberkulosis dunia, termasuk Indonesia dengan target Indonesia bebas TBC 2030.
Melihat beberapa alasan tersebut dan membandingkan dengan data di lapangan, memang dapat disimpulkan bahwa vaksin BCG nyatanya memang belum mampu untuk menurunkan angka penderita TBC di Indonesia, bahkan dengan penggunaan vaksin tersebut selama beberapa tahun terakhir, angka penderita TBC di Indonesia kian meningkat dan justru telah mencapai peringkat ke-2 di dunia. Hal ini semakin mendorong urgensi untuk pembaruan vaksin TB yang baru agar segera dikembangkan dan disempurnakan.
Menteri Kesehatan, Budi Gunawan Sadikin, menjelaskan Vaksin M72 ini telah memasuki uji klinik tahap 3 dan sedang dilakukan uji klinik di tujuh negara, termasuk Indonesia. Indonesia menjadi salah satu tempat uji coba klinik ini karna jumlah angka mortalitas dan morbiditas TB di Indonesia semakin meningkat. Alasan lain adalah karena dengan melakukan uji coba klinik fase 3 di Indonesia maka dapat diketahui kecocokan vaksin dengan genetik orang Indonesia. Selain itu, pengadaan uji klinik di Indonesia juga membantu para ilmuwan dalam negeri bisa mendapatkan akses langsung terhadap teknologi vaksin karna bekerja sama dengan Universitas Padjadjaran dan Universitas Indonesia.
Keamanan Vaksin M72
Vaksin M72 telah melalui uji klinik fase 1 dan 2 dan sekarang memasuki uji klinik fase 3. CDC menjelaskan bahwa uji klinik tahap 3 merupakan uji klinik terakhir yang dilakukan sebelum suatu obat atau vaksin dapat mendapatkan izin dari FDA (Food and Drug Administration) untuk digunakan secara luas pada populasi umum. Dalam fase ini, pengujian vaksin melibatkan sekitar 1000-3000 orang untuk mengetahui seberapa baik vaksin bekerja, bagaimana efikasi dari vaksin tersebut, memantau efek samping yang dapat terjadi, serta mengumpulkan informasi-informasi penting untuk mendukung penggunaan yang aman pada masyarakat umum(CDC. How Vaccines are Developed and Approved for Use).
Di Indonesia sendiri, BPOM (Badan Pengawasan Obat dan Makanan) menerangkan melalui Peraturan BPOM No. 8 Tahun 2024 tentang Tata Laksana Persetujuan Pelaksanaan Uji Klinik, bahwa Uji Klinik terdiri atas 4 fase. Uji klinik fase 3 bertujuan untuk menentukan keamanan dan efikasi jangka pendek serta jangka panjang zat aktif, dan mengetahui efek terapetik secara umum maupun relatif. Tahap uji klinik ini melibatkan lebih banyak partisipan dari tahap 2.
Memahami hal tersebut, maka perlu kita pahami bagaimana hasil dari uji klinik tahap 2 vaksin M72 ini. Artikel dalam Biomedical Journal (BMJ) menjelaskan, berbeda dengan vaksin BCG yang kandungannya menggunakan bakteri Mycobacterium bovis yang dilemahkan, vaksin M72 mengandung protein fusi rekombinan (M72) yang berasal dari antigen Mtb, bersama dengan sistem adjuvan (AS01E) untuk meningkatkan respons imun (Mahase E. Tuberculosis: How close are we to a new vaccine? BMJ 2024)
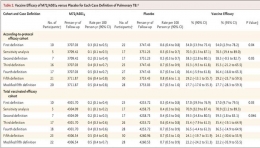
Menurut hasil penelitian yang dipublikasikan dalam The New England Journal of Medicine pada tahun 2018, diperoleh konklusi bahwa “Efikasi vaksin M72/AS01E memberikan perlindungan 54,0% untuk orang dewasa yang terinfeksi M. tuberculosis terhadap penyakit tuberkulosis paru aktif, tanpa masalah keamanan yang nyata”. Penelitian ini merupakan uji coba klinik fase 2 terkontrol yang melibatkan populasi penelitian di negara Kenya, Afrika Selatan, dan Zambia (Van Der Meeren, Olivier, et al. “Phase 2b Controlled Trial of M72/AS01E Vaccine to Prevent Tuberculosis.” New England Journal of Medicine)

Sebuah meta-analisis dan systematic review yang dilakukan pada tahun 2020 menemukan kesimpulan bahwa “Vaksin M72/AS01E dan MVA85A untuk TB aman dan telah menunjukkan imunogenisitas dalam berbagai uji klinik. Vaksin M72/AS01E dan MVA85A dikaitkan dengan efek samping ringan.” Temuan studi meta-analisis ini menunjukkan bahwa M72/AS01E dan MVA85A memiliki imunogenisitas dan secara umum ditemukan aman pada populasi yang divaksinasi BCG dan yang tidak divaksinasi, dan pada HIV-positif dan negatif, dan bahkan di antara populasi yang sebelumnya terinfeksi M. tuberculosis (Ullah, Inayat, et al. “The Systematic Review and Meta-Analysis on the Immunogenicity and Safety of the Tuberculosis Subunit Vaccines M72/AS01E and MVA85A.” Frontiers in Immunology)
Beberapa hasil penemuan ini sebenarnya menunjukkan dari hasil uji klinik fase 2, vaksin M72 relatif aman dan memiliki efek samping ringan sehingga wajar untuk dilanjutkan penelitiannya ke uji klinik fase 3.
Harkat Uji Klinik, Peluang Untuk Indonesia
Indonesia ditetapkan sebagai salah satu dari beberapa negara sebagai tempat uji klinik fase 3 vaksin M72 ini harus dilihat dalam sudut pandang yang lebih optimis. Melihat hasil uji klinik fase 2 yang relatif aman, tidak ada salahnya untuk merasa bahwa uji klinik fase 3 pun akan membawa hasil yang sama. Apalagi jika uji klinik fase 3 ini terbukti efikasinya tinggi di Indonesia, Indonesia bisa langsung mendapat izin dan akses teknologi vaksin tersebut untuk segera digunakan secara luas di Indonesia. Pemerintah melalui Kementerian Kesehatan dapat segera menerapkan serangkaian regulasi agar vaksin ini dapat segera dimanfaatkan secara efektif sehingga dapat dievaluasi hasilnya yang (semoga) dapat menurunkan angka morbiditas dan mortalitas akibat TB di Indonesia.
Untuk dapat memanfaatkan peluang itu semaksimal mungkin, serta memastikan vaksin ini betul-betul aman secara risiko dan efek samping, maka tetap perlu diperhatikan pedoman Cara Uji Klinik yang Baik (CUKB). Pasal 5 ayat (1) Peraturan BPOM no. 8 tahun 2024 menegaskan bahwa Uji Klinik harus berpedoman pada CUKB. Dalam lampiran 1 Peraturan yang sama dijelaskan, CUKB adalah suatu standar kualitas etik dan ilmiah internasional untuk mendesain, melaksanakan, mencatat, dan melaporkan Uji Klinik yang melibatkan partisipasi subjek manusia. Mematuhi standar ini akan memberi kepastian kepada publik bahwa hak, keamanan, dan kesejahteraan Subjek Uji Klinik dilindungi sesuai dengan prinsip yang berasal dari Deklarasi Helsinki, serta bahwa data Uji Klinik tersebut dapat dipercaya. Selain itu, lebih jauh lagi dalam pasal 6 ditegaskan bahwa Uji Klinik yang dilaksanakan di Indonesia wajib memperoleh PPUK (Persetujuan Pelaksanaan Uji Klinik) dari BPOM dimana PPUK ini diberikan setelah memperoleh persetujuan dari Komite Etik Penelitian Kesehatan (KEPK) sebelum uji klinik tersebut dapat dilakukan.

Indonesia sudah punya regulasi yang mengikat, sudah punya pedoman yang jelas, sudah punya standar yang ketat untuk memastikan keamanan. Jika semuanya dipatuhi dengan benar dan sesuai prosedur, maka uji klinik tahap 3 ini akan menjadi prosedur yang aman bagi partisipan. Dengan tetap memperhatikan kebebasan partisipan subjek penelitian untuk memberikan persetujuan (consent) setelah diberikan penjelasan sesuai dengan pedoman Cara Uji Klinik yang Baik. Pemerintah hanya perlu meneguhkan berlakunya segala standar ini, alih-alih secara mentah menerima program uji coba vaksin yang disponsori oleh perusahaan asing, Indonesia dalam hal ini pemerintah pusat perlu memanfaatkan momentum ini dengan memastikan uji klinik berjalan sesuai prosedur yang berlaku, meminimalkan segala risiko buruk yang mungkin terjadi, serta memaksimalkan segala hasil positif dari program ini dapat dimanfaatkan sebesar-besarnya untuk Indonesia yang lebih sehat, untuk Indonesia yang bebas TBC.
REFERENSI
BPOM , Peraturan BPOM no. 8 tahun 2024 tentang Tata Laksana Persetujuan Pelaksanaan Uji Klinik
CDC. How Vaccines are Developed and Approved for Use. https://www.cdc.gov/vaccines/basics/how-developed-approved.html
Mahase E. Tuberculosis: How close are we to a new vaccine? BMJ 2024; 387:q2410doi:10.1136/bmj.q2410.https://www.bmj.com/content/387/bmj.q2410
Ullah, Inayat, et al. “The Systematic Review and Meta-Analysis on the Immunogenicity and Safety of the Tuberculosis Subunit Vaccines M72/AS01E and MVA85A.” Frontiers in Immunology, vol. 11, 8 Oct. 2020, https://doi.org/10.3389/fimmu.2020.01806.
Van Der Meeren, Olivier, et al. “Phase 2b Controlled Trial of M72/AS01E Vaccine to Prevent Tuberculosis.” New England Journal of Medicine, vol. 379, no. 17, 25 Oct. 2018, pp. 1621–1634,https://doi.org/10.1056/nejmoa1803484
WHO, Global TB Report 2024
Follow Instagram @kompasianacom juga Tiktok @kompasiana biar nggak ketinggalan event seru komunitas dan tips dapat cuan dari Kompasiana. Baca juga cerita inspiratif langsung dari smartphone kamu dengan bergabung di WhatsApp Channel Kompasiana di SINI

![[sospol] Bayangan di Balik Asap](https://assets-a2.kompasiana.com/items/album/2025/09/01/hantu-68b5807bed6415329217f842.jpg?t=t&v=100&x=100&info=meta_related)