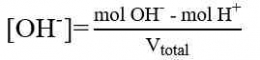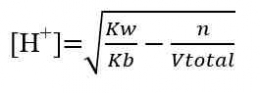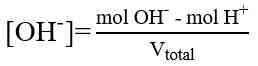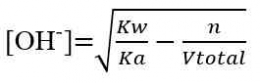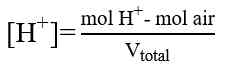3. Labu Erlenmeyer
Labu Erlenmeyer berfungsi sebagai wadah untuk larutan yang akan dianalisis (analit).
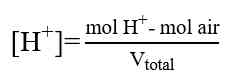
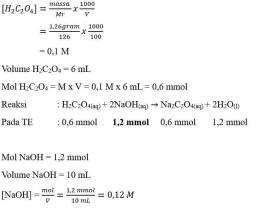
Perhitungan dalam Titrasi Asam-Basa
Perhitungan konsentrasi dalam menentukan konsentrasi larutan didasarkan atas besaran normal “N”, yaitu besaran yang menyatakan gram ekuivalen (grek) zat terlarut dalam setiap 1 Liter larutan. Namun perhitungan juga dapat dilakukan dengan menggunakan perhitungan molaritas (M) yang lebih sederhana. Beberapa perhitungan yang diperlukan adalah sebagai berikut.
1. Pembuatan Larutan Standar
Pembuatan larutan standar dengan konsentrasi tertentu dapat dihitung dengan menggunakan persamaan berikut.
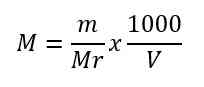
Keterangan
M = molaritas larutan (mol/L)
m = massa yang akan dilarutkan (gram)
Mr = massa molekul relatif zat yang akan dilarutkan