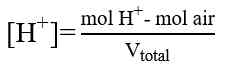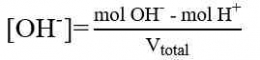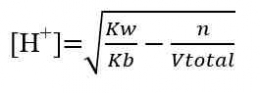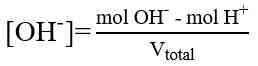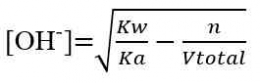Dalam kehidupan sehari-hari, kadar suatu zat dalam larutan perlu diketahui untuk dapat digunakan dalam berbagai keperluan, misalnya kandungan asam hipoklorit (HClO) dalam pemutih pakaian, asam benzoat (C6H5COOH) dalam desinfektan, asam format (HCOOH) dalam formalin untuk tekstil, kandungan basa dalam obat maag, hingga kandungan oksigen dalam perairan. Salah satu cara untuk menentukan kadar zat dalam suatu larutan adalah metode titrasi. Berdasarkan jenis reaksi yang terjadi, titrasi dapat dibagi menjadi 3 yaitu titrasi asam-basa (penetralan), titrasi pengendapan, dan titrasi redoks.
Kandungan asam atau basa dalam makanan dapat ditentukan dengan titrasi asam-basa. Asam asetat (CH3COOH) yang merupakan asam lemah dapat dititrasi dengan menggunakan larutan natrium hidroksida (NaOH) yang merupakan larutan standar basa kuat.
Titrasi asam-basa adalah metode analisa kimia untuk menentukan konsentrasi larutan asam atau basa berdasarkan reaksi netralisasi. Dalam proses titrasi, ke dalam buret ditambahkan larutan standar yang selanjutnya dititrasi ke dalam larutan yang dianalisis (analit). Penambahan larutan standar ke dalam larutan analit dilakukan sedikit demi sedikit hingga terjadi reaksi yang sempurna disebut dengan titik ekuivalen. Titik ekuivalen terjadi apabila secara stoikiometri jumlah mol asam dan basa habis bereaksi yang ditandai dengan adanya perubahan warna pada larutan yang dianalisis. Perubahan warna disebabkan oleh adanya larutan standar atau larutan indikator yang ditambahkan sebelum titrasi.
Titrasi dihentikan tepat pada saat indikator menunjukkan perubahan warna yang disebut titik akhir titrasi. Hasil titrasi yang tepat dapat diperoleh apabila selisih antara titik akhir titrasi dengan titik ekivalen sangat kecil meskipun dalam praktiknya titik akhir titrasi hampir selalu tidak sama dengan ekuivalen yang menyebabkan ralat hitung. Hal ini disebabkan karena pada saat titik ekuivalen, indikator memberikan perubahan warna yang tidak tepat. Dengan demikian, pemilihan indikator yang tepat akan memberikan perubahan warna di sekitar titik ekuivalen, sehingga hasil titrasi akan mendekati sebenarnya.
Perangkat Titrasi
Dalam proses titrasi, alat-alat kimia utama yang biasa digunakan adalah sebagai berikut.
1. Buret
Buret berfungsi sebagai tempat titran (larutan standar) dan untuk mengukur volume titran yang ditambahkan ke larutan sampel. Buret memiliki skala yang memungkinkan pembacaan volume dengan tingkat akurasi tinggi.
2. Statif dan klem
Statif dan klem berfungsi untuk menyangga buret selama proses titrasi.
3. Labu Erlenmeyer
Labu Erlenmeyer berfungsi sebagai wadah untuk larutan yang akan dianalisis (analit).
Perhitungan dalam Titrasi Asam-Basa
Perhitungan konsentrasi dalam menentukan konsentrasi larutan didasarkan atas besaran normal “N”, yaitu besaran yang menyatakan gram ekuivalen (grek) zat terlarut dalam setiap 1 Liter larutan. Namun perhitungan juga dapat dilakukan dengan menggunakan perhitungan molaritas (M) yang lebih sederhana. Beberapa perhitungan yang diperlukan adalah sebagai berikut.
1. Pembuatan Larutan Standar
Pembuatan larutan standar dengan konsentrasi tertentu dapat dihitung dengan menggunakan persamaan berikut.
Keterangan
M = molaritas larutan (mol/L)
m = massa yang akan dilarutkan (gram)
Mr = massa molekul relatif zat yang akan dilarutkan
V = volume labu ukur yang digunakan (mL)
Langkah-langkah membuat larutan standar:
1. Tentukan molaritas larutan yang diinginkan dan volume labu ukur yang akan digunakan untuk membuat larutan
2. Hitung massa zat yang harus digunakan dengan menggunakan rumus pembuatan larutan standar.
3. Timbang zat yang akan digunakan sesuai hasil perhitungan dan kemudian masukkan ke dalam labu ukur dengan volume yang sudah ditentukan sebelumnya.
4. Tambahkan aquades ke dalam labu ukur hingga setengah labu.
5. Gojog campuran untuk melarutkan zat terlarut dengan cara menggojok labu ukur.
6. Setelah zat terlarut, tambahkan aquades hingga tanda batas.
7. Sumbat labu dan gojog kembali agar larutan homogen.
2. Pengenceran Larutan
Pengenceran larutan dapat dilakukan apabila larutan standar maupun larutan yang akan dianalisis terlalu pekat. Pengenceran dapat dilakukan dengan menambahkan sejumlah pelarut melalui perhitungan pengenceran molaritas.
M2 . V2 = M1 . V1
Keterangan:
M1 = Molaritas awal
M2 = Molaritas setelah pengenceran
V1 = Volume awal
V2 = Volume setelah pengenceran
3. Penentuan Konsentrasi Zat yang Dianalisis
Pada titik ekuivalen berlaku: perbandingan jumlah mol zat-zat yang bereaksi sama dengan perbandingan koefisien reaksinya, sehingga dapat disimpulkan bahwa pada saat terjadi titik ekuivalen berlaku persamaan:
na . Ma . Va = nb . Mb . Vb
Keterangan:
n = valensi asam atau basa
M = Molaritas asam atau basa
V = Volume asam atau basa
Contoh:
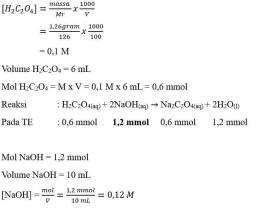
Larutan standar dibuat dari 1,26gram kristal asam oksalat dihidrat (H2C2O4.2H2O) yang dilarutkan dengan aquades dalam labu ukur 100 mL dan diencerkan sampai tanda batas. Larutan ini sebagai titran untuk menitrasi 10 mL larutan NaOH. Volume asam oksalat yang diperlukan sampai titik ekuivalen adalah 6 mL. Tentukan konsentrasi larutan NaOH.
Jawab:

na . Ma . Va = nb . Mb . Vb
2 x 0,1 M x 6 mL = 1 x M x 10 mL
[NaOH] = 1,2 mmol/10 mL = 0,12 M
Grafik Titrasi Asam Basa
1. Titrasi Asam Kuat-Basa Kuat
Pada titik ekuivalen terbentuk garam yang tidak bisa dihidrolisa oleh air, sehingga larutan bersifat netral dan pH = 7.
a. Sebelum TE

b. Sesudah TE

c. Kurva Titrasi
Titrasi Basa Lemah-Asam Kuat
Titik ekuivalen < 7
a. Pada TE

b. Grafik Titrasi
Titrasi Basa Kuat-Asam Kuat
Pada titik ekuivalen terbentuk garam yang tidak bisa dihidrolisa oleh air, sehingga larutan bersifat netral dan pH = 7.
a. Sebelum TE

b. Sesudah TE

c. Kurva Titrasi
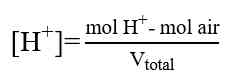
Titrasi Asam Lemah-Basa Kuat
Titik ekuivalen > 7
a. Pada TE

b. Kurva Titrasi