Persamaan termokimia merupakan persamaan reaksi yang disertai dengan perubahan entalpi (ΔH). Besarnya nilai perubahan entalpi pada persamaan termokimia harus sesuai dengan stoikiometri reaksi, dengan kata lain jumlah mol zat yang terlibat sama dengan koefisien reaksinya.
Contoh:
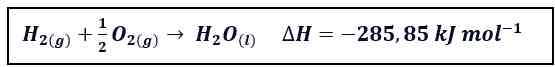
Perubahan Entalpi Reaksi
Penentuan perubahan entalpi pada suatu reaksi dilakukan melalui eksperimen. Eksperimen tersebut biasanya menggunakan alat seperti kalorimeter, hukum Hess dan energi ikatan.
- Kalorimetri
Sesuai dengan namanya, percobaan dengan kalorimeter dapat digunakan untuk menentukan kalor reaksi, sedangkan proses pengukurannya disebut dengan kalorimetri. Tabel-tabel yang memberikan informasi terkait data H pada umumnya ditentukan melalui proses kalorimetri. Kalorimetri sederhana merupakan proses mengukur perubahan suhu dalam suatu wadah terisolasi dari sejumlah air atau larutan yang merupakan akibat dari suatu reaksi kimia. Kalorimeter dapat dilihat melalui gambar ini.
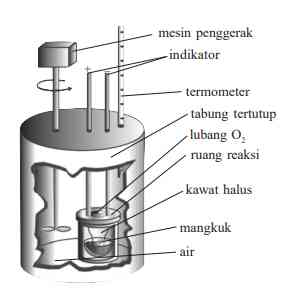
Jumlah kalor dari bahan nonkonduktor yang dapat berpindah ke lingkungan dapat diabaikan.
- Jika reaksi tergolong eksoterm, kalor sepenuhnya akan diserap oleh larutan dalam gelas.
- Jika reaksi tergolong endoterm, kalor sepenuhnya akan diserap dari larutan dalam gelas.
Sehingga proses kalorimetri menyimpulkan bahwa “kalor reaksi sama dengan jumlah kalor yang diserap atau dilepaskan larutan dalam gelas yang dapat ditentukan melalui proses mengukur perubahan suhunya”. Berdasarkan hukum kekekalan energi, maka:

q = jumlah kalor (J)
























