Pembahasan tentang ikatan kimia tidak terlepas dari topik tentang bagaimana cara atom-atom berinteraksi dan bergabung dalam pembentukan molekul. Beberapa aspek yang penting untuk dibahas adalah tentang teori lewis yang menjabarkan bagaimana atom-atom berikatan dalam ikatan kimia, apa itu muatan formal, bagaimana teori VSEPR yang mampu membantu memprediksi bentuk molekul, tentang teori hibridisasi, serta pembahasan tentang teori ikatan valensi.
Lewis pertama kali memperkenalkan tentang konsep sederhana ikatan kovalen. Ikatan kovalen adalah ikatan yang terbentuk akibat penggunaan elektron bersama, yang otomatis membantuk senyawa kovalen, dan dapat berupa ikatan tunggal maupun ikatan rangkap. Pembentukan ikatan kovalen digambarkan dengan menggunakan aturan oktet yang diperkenalkan oleh Lewis.
Aturan oktet menyatakan bahwa atom akan cenderung berikatan sampai atom tersebut dikelilingi oleh delapan elektron valensi (meskipun sebagian dari elektron tersebut dipakai bersama dengan elektron lain). Beliau juga mengenalkan tentang struktur lewis dengan sistem titik untuk menggambarkan eletron terluar atau elektron valensi.
Dalam struktur lewis, dikenal pula istilah struktur resonansi, yang menggambarkan keadaan di mana suatu molekul atau ion dapat diwakili oleh dua atau lebih struktur Lewis yang valid, seperti molekul benzena (C6H6), Ion Nitrat (NO), dan Ion Ozon (O3-). Untuk menentukan struktur resonansi yang paling stabil dari sebuah molekul, dapat menggunakan muatan formal. Muatan formal menyatakan selisih elektron valensi dalam atom bebas dengan jumlah elektron atom tersebut dalam struktur lewis.
Langkah-langkah untuk menghitung muatan formal dimulai dengan menghitung jumlah total elektron valensi setiap atom dalam molekul, kemudian membuat gambaran struktur lewisnya. Terakhir, jumlah muatan formal dihitung dengan mengurangi total jumlah elektron yang seharusnya dimiliki atom dengan jumlah elektron yang dimiliki dalam struktur Lewis.
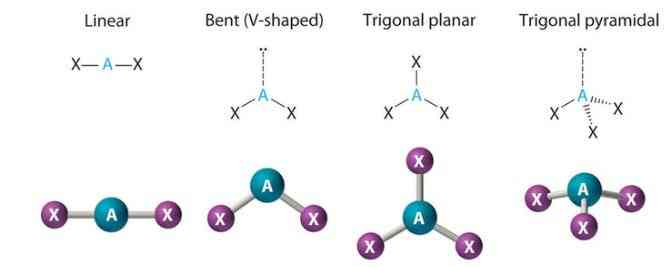
Bentuk geometris sebuah molekul dapat ditentukan menggunakan Teori VSEPR (Valence Shell Elektron Pair Repulsion) berdasarkan gaya tolak pasangan elektron pada atom pusat.
Prinsipnya, pasangan elektron di sekitar atom pusat akan saling tolak dan mengatur dirinya sendiri sehingga gaya tolak paling minimum, dan membentuk bentuk molekul yang spesifik.
Beberapa bentuk geometris sebuah molekul menurut VSEPR antara lain: bentuk linier (dengan 2 pasangan elektron), triagonal planar (dengan 3 pasangan elektron), tetrahedral (4 pasangan elektron), trigonal bipiramida (5 pasangan elektron), dan oktahedral (6 pasangan elektron).

Bagaimana atom-atom dalam sebuah molekul dapat berikatan dapat dijelaskan dengan teori hibridisasi. Teori hibridisasi ini menjelaskan tentang penggabungan orbital atom untuk membentuk orbital hibrida yang sesuai dengan ikatan kimia, dengan mengkombinasikan orbital atom menjadi orbital hibrid.
Hibridisasi di dalam konsep kimia merupakan proses pencampuran atau penggabungan orbital atom untuk menghasilkan orbital hibrid, yaitu orbital yang identik dalam bentuk dan energi yang dimilikinya. Teori hibridisasi penting dipelajari untuk membantu dalam menentukan bentuk geometris molekul, membantu menjelaskan kekuatan serta sifat ikatan molekul, dan menentukan reaktivitas dan sifat kimia molekul.
Muara dari seluruh konsep-konsep kimia dasar yang telah disebutkan sebelumnya adalah teori ikatan valensi. Teori ikatan valensi atau valence bond theory (VBT) adalah konsep yang menjelaskan tentang bagaimana atom dalam molekul saling berikatan melalui orbital yang saling tumpang tindih dengan elektron yang tidak berpasangan.
Teori ikatan valensi menjelaskan secara detail tentang sifat-sifat ikatan kimia dalam molekul dengan mempertimbangkan konfigurasi valensi atomnya. Menurut teori VBT, ikatan kimia terbentuk saat dua atom berbagi pasangan elektron, yang ditempatkan pada orbital yang saling tumpang tindih. Prinsip dasar teori ikatan valensi antara lain: 1) elektron yang terlibat adalah elektron valensi pada orbital terluar atom, 2) ikatan kimia terbentuk karena overlap (tumpang tindih) antara dua orbital atom yang masing-masing memiliki satu elektron tidak berpasangan. Overlap tersebut dapat berupa overlap sigma (), atau pi (), tergantung orientasi orbital yang terlibat. 3) menggunakan konsep hibridisasi untuk menjelaskan geometri molekul dan bentuk orbtal hibrid.
Teori Ikatan Valensi merupakan dasar penting dalam memahami pembentukan ikatan dan struktur molekul, meskipun penggunaannya bersamaan dengan teori lain, untuk memberikan gambaran lebih jelas dan lengkap tentang sifat molekul.













