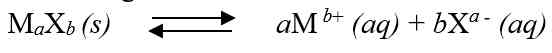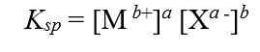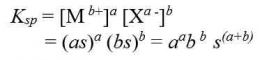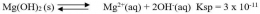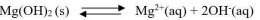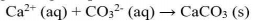Pernahkah kalian melarutkan sejumlah garam dapur dalam larutan air? Ketika kalian melarutkan satu sendok garam dapur ke dalam satu gelas air, maka garam tersebut akan larut. Namun, bagaimana jika garam dapur ditambahkan lebih banyak lagi? Jika jumlah garam yang dilarutkan terus ditambah, maka garam yang ditambakan tidak dapat lagi larut. Mengapa hal tersebut dapat terjadi? Meskipun demikian, garam dapur tetap digolongkan ke dalam garam yang mudah larut dalam air. Jika yang kita larutkan adalah garam yang sukar larut dalam air, maka hanya sedikit sekali garam yang dapat terlarut.
Banyak sedikitnya jumlah zat yang dapat larut dalam air tergantung nilai kelarutannya. Kelarutan (solubility) merupakan jumlah maksimal zat terlarut (dalam gram) yang dapat larut dalam sejumlah tertentu pelarut pada suhu tertentu. Sedangkan kelarutan molar adalah jumlah mol maksimal zat terlarut yang dapat larut dalam sejumlah tertentu pelarut pada suhu tertentu.
Jika kita melarutkan zat tertentu, kemudian jumlahnya terus kita tambah, maka akan tercapai suatu kondisi tertentu yang pada saat itu jumlah zat yeng telah larut mencapi batas maksimalnya (kelarutan). Kondisi seperti ini yang disebut larutan telah jenuh. Pada larutan yang telah jenuh terjadi kesetimbangan antara proses pelarutan dan pembentukan kristal (endapan). Oleh kareana itu, jika kita tambahkan lagi sejumlah zat terlarut, maka akan terjadi pergeseran kesetimbangan ke arah pembentukan endapan, sehingga zat yang kita tambahkan seolah-olah tidak larut.
Kelarutan dari senyawa ion yang mudah larut dalam air biasanya dinyatakan dalam gram per 100 mL. sedangkan kelarutan senyawa ion yang sukar larut dalam air dinyatakan dalam mol/L.
Tetapan Hasil Kelarutan
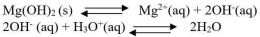
Secara umum, untuk kesetimbangan kelarutan berikut:
tetapan hasil kali kelarutannya dapat dirumuskan sebgai berikut:
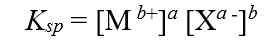
Tetapan hasil kali kelarutan hanya berlaku pada larutan jenuh, dan Ksp tidak mempunyai satuan.
Berikut ini nilai tetapan hasil kali kelarutan beberapa senyawa pada 25⁰C.