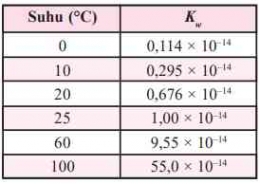
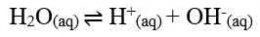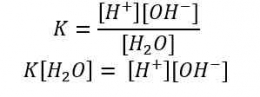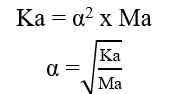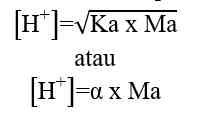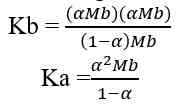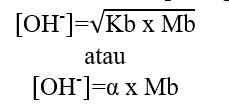H+] = Ma x a
Keterangan:
[H+] = konsentrasi ion H+ (mol/L atau M)
Ma = molaritas asam kuat (mol/L atau M)
a = valensi asam kuat
- Basa Kuat
Basa kuat dapat terionisasi secara sempurna dalam air. Dalam larutan asam, jumlah ion OH- lebih banyak dibandingkan ion H+.
Rumus perhitungan konsentrasi ion OH- dalam larutan asam.
[OH-] = Mb x b
Keterangan:
[OH-] = konsentrasi ion OH- (mol/L atau M)
Mb = molaritas basa kuat (mol/L atau M)
Beri Komentar
Belum ada komentar. Jadilah yang pertama untuk memberikan komentar!