Sudahkan Anda mengenal struktur atom? Pada materi sebelumnya kita sudah mempelajari tentang struktur atom yang terus mengalami perubahan hingga akhirnya struktur atom digambarkan memiliki inti yang terdiri atas atom bermuatan positif yang disebut proton dan neutron, yang dikelilingi oleh elektron yang bermuatan negatif. Lantas bagaimana peredaran elektron di dalam atom? Nah, pada materi ini kita akan membahas terkait bilangan kuantum yang menggambarkan penyebaran elektron di dalam atom.
Bilangan kuantum merupakan bilangan yang mendeskripsikan peredaran elektron dalam atom hidrogen dan atom-atom lain. Nilai dari bilangan ini akan digunakan untuk menjelaskan orbital-orbital atom dan menandai elektron-elektron di dalamnya. Orbital merupakan daerah dengan kebolehjadian tertinggi ditemukannya elektron didalam daerah ruang seperti atom. Dimana setiap orbital mempunyai ukuran, bentuk, dan orientasi tertentu. Maka dapat disimpulkan bahwa bilangan kuantum dapat menggambarkan tingkat energi, bentuk, dan orientasi elektron dalam suatu orbital. Bilangan-bilangan ini merupakan turunan dari solusi sistematis persamaan Schrodinger untuk atom hidrogen. Dalam persamaan Schrodinger, nilai-nilai yang diizinkan adalah bilangan kuantum utama (n), bilangan kuantum azimuth atau momentum sudut (l), dan bilangan kuantum magnetik (m). Selain itu terdapat pula bilangan kuantum spin elektron (s) yang menunjukkan perilaku elektron pada sumbunya dan melengkapi gambaran terkait elektron dan atom.
Macam-macam Bilangan Kuantum
1. Bilangan Kuantum Utama (n)
Bilangan kuantum utama (n) merupakan suatu harga yang menyatakan ukuran dan tingkat energi/kulit dalam atom. Terdapat beberapa jenis kulit pada teori atom Bohr yang akan digunakan untuk menyatakan tingkat energi yaitu seperti kulit K, L, M, N, dan seterusnya. Bilangan kuantum ini dinyatakan dalam bilangan bulat, positif, dan bukan nol n = 1, 2, 3, 4, ....
Melalui tabel di atas nilai n=1 menunjukkan kulit elektron yang paling dalam dari sebuah atom yang artinya elektron berada pada keadaan dasar atau keadaan energi terendah. Selain itu, bilangan kuantum juga dapat meramalkan jarak rata-rata elektron dari inti dalam orbital tertentu. Dengan demikian, semakin besar n, maka semakin besar jarak rata-rata elektron dalam orbital dari inti dan oleh karena itu semakin besar orbitalnya, begitu juga tingkat energinya. Energi dalam atom hanya bergantung pada bilangan kuantum n dan bilangan kuantum utama merupakan dasar penentuan nilai dari bilangan kuantum lainnya.
Contoh soal: Tentukan bilangan kuantum utama (m) dari elektron terakhir pada unsur 20Ca!
20Ca = 2 8 8 2
K L M N
Jawab: Bilangan kuantum utama dari elektron terakhir pada unsur 20Ca adalah n = 4
2. Bilangan Kuantum Azimuth atau Momentum Sudut (l)
Bilangan kuantum azimuth atau momentum sudut (l) adalah suatu harga yang menyatakan tingkat energi elektron pada subkulit dan menyatakan bentuk orbital. Subkulit elektron mempunyai lambang s, p, d, f, dan seterusnya yang berasal dari nama-nama seri spektrum unsur yaitu sharp (s), principal (p), diffuse (d), dan fundamental (f).

Banyaknya subkulit tempat elektron berada bergantung pada nilai bilangan kuantum utama (n), bilangan kuantum momentum sudut l bernilai bulat dari 0 hingga n --1. Bila n = 1, hanya ada satu nilai l yang mungkin yaitu l = n -- 1 = 1 -- 1 = 0. Bila n = 2, ada dua nilai l, yaitu 0 dan 1. Bila n = 3, ada tiga nilai l, yaitu 0, 1, 2.
Sehingga:
Jika n = 1 maka l = 0
Jika n = 2 maka l = 0, 1
Jika n = 3 maka l = 0, 1, 2
Jika n = 4, maka l = 0, 1, 2, 3
Orbital-orbital dengan nilai n yang sama sering disebut dengan kulit. Sedangkan satu atau lebih orbital dengan nilai n dan l yang sama dikatakan sebagai subkulit. Misalnya, kulit dengan n = 3 terdiri atas 3 subkulit yaitu, l = 0, 1, 2 (nilai l yang diizinkan untuk n = 3). Subkulit ini disebut sebagai subkulit 3s, 3p, 3d dimana 3 melambangkan nilai n, dan s, p, dan d melambangkan nilai l. Semakin besar nilai n, maka semakin besar ukuran orbital dan semakin tinggi tingkat energinya.
Contoh soal: Tentukan bilangan kuantum azimuth untuk elektron terakhir dari unsur 20Ca!
20Ca = 1s2 2s2 2p6 3s2 3p6 4s2
Jawab: Bilangan kuantum azimuth untuk elektron terakhir dari unsur 20Ca adalah l = 0
3. Bilangan Kuantum Magnetik (m)
Bilangan kuantum magnetik (m) adalah suatu harga yang menyatakan orientasi orbital atau arah momentum sudut elektron dalam ruang. Orientasi orbital artinya tempat elektron bergerak di dalam atom, dimana masing-masing orbital menampung maksimal dua elektron atau sepasang. Nilai m bergantung pada bilangan kuantum azimuth yaitu semua bilangan bulat dari m = -l hingga +l termasuk nol (m = -l, ..., 0, ..., +l). Dengan demikian, setiap harga l yang diberikan pada setiap sub kulit, akan mendapat nilai m sebanyak (2l + 1).

4. Bilangan Kuantum Spin Elektron (s)
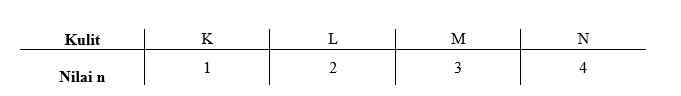
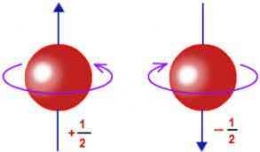
Bilangan kuantum spin elektron (s) adalah suatu harga yang menyatakan kedudukan dan arah putaran elektron pada suatu orbital. Seorang fisikawan mengansumsikan bahwa elektron berperilaku seperti magnet kecil. Elektron pada orbital tidak hanya bergerak di sekitar inti saja melainkan berputar pada sumbunya seperti rotasi bumi, sehingga sifat magnetiknya dapat dijelaskan. Teori elektromagnetik menjelaskan bahwa muatan yang berputar pada sumbunya akan menghasilkan medan magnet, sehingga menyebabkan gerakan elektron seperti medan magnet. Gerak elektron merupakan gerak yang searah dengan jarum jam dan berlawanan arah dengan jarum jam.
Di dalam suatu orbital terdapat dua elektron, sedangkan keduanya memiliki kutub pada orbital, maka dua elektron ini berputar mengelilingi sumbu dengan arah yang berlawanan, sehingga nilai elektron yang berpasangan dalam orbital harus berbeda. Perbedaan tersebut dinyatakan pada bilangan kuantum spin suatu elektron dalam orbital yang dapat bernilai +1/2 untuk searah jarum jam dan -1/2 untuk yang berlawanan arah jarum jam.
Follow Instagram @kompasianacom juga Tiktok @kompasiana biar nggak ketinggalan event seru komunitas dan tips dapat cuan dari Kompasiana. Baca juga cerita inspiratif langsung dari smartphone kamu dengan bergabung di WhatsApp Channel Kompasiana di SINI