Konon kata orang dulu kalau mirip itu artinya jodoh,bener ga sih?
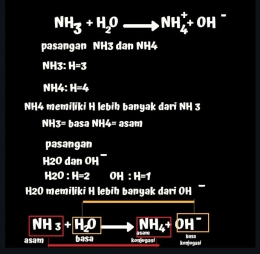
Nah, kemudian selisih asam dan basa H-nya 1 saja. Cara menentukan pasangan asam basa bronsted lowry adalah seperti berikut:

Kedua teori Asam basa lewis
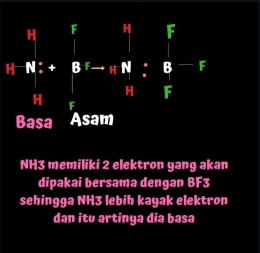
Jika bronsted lowry membahas proton maka Lewis membicarakan elektron. Suatu zat di katakan asam jika dia meminta elektron sementara basa kebalikannya punya banyak elektron dan siap memberikan elektronnya
Misalkan NH3 akan berikatan dengan BF3. NH3 masih memiiki sepasang elektron.
Jika BF3 datang meminang dalam keadaan miskin elekteon,maka NH3 akan menyumbangkan elektronnya demi keberlangsungan hubungan mereka berdua halah.
Tapi ingat ya itu elekton nya NH3 bukan elektron gono-gini yang nanti akan diperbutkan saat mereka bercerai!
Berikut ilustrasi Lewis antara NH3 dan BF3

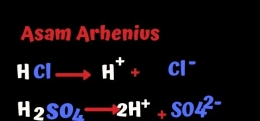
Menurut Arrhenius asam adalah zat yang jika dilarutkan akan terionisasi dan melepaskan H+conton asam misal HCl, H2SO4. Ini dia reaksi ionisasinya: Adda.