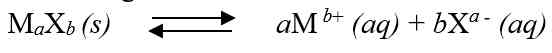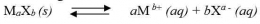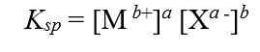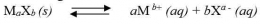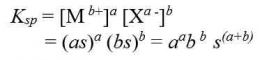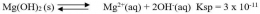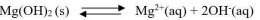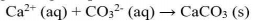Pernahkah kalian melarutkan sejumlah garam dapur dalam larutan air? Ketika kalian melarutkan satu sendok garam dapur ke dalam satu gelas air, maka garam tersebut akan larut. Namun, bagaimana jika garam dapur ditambahkan lebih banyak lagi? Jika jumlah garam yang dilarutkan terus ditambah, maka garam yang ditambakan tidak dapat lagi larut. Mengapa hal tersebut dapat terjadi? Meskipun demikian, garam dapur tetap digolongkan ke dalam garam yang mudah larut dalam air. Jika yang kita larutkan adalah garam yang sukar larut dalam air, maka hanya sedikit sekali garam yang dapat terlarut.
Banyak sedikitnya jumlah zat yang dapat larut dalam air tergantung nilai kelarutannya. Kelarutan (solubility) merupakan jumlah maksimal zat terlarut (dalam gram) yang dapat larut dalam sejumlah tertentu pelarut pada suhu tertentu. Sedangkan kelarutan molar adalah jumlah mol maksimal zat terlarut yang dapat larut dalam sejumlah tertentu pelarut pada suhu tertentu.
Jika kita melarutkan zat tertentu, kemudian jumlahnya terus kita tambah, maka akan tercapai suatu kondisi tertentu yang pada saat itu jumlah zat yeng telah larut mencapi batas maksimalnya (kelarutan). Kondisi seperti ini yang disebut larutan telah jenuh. Pada larutan yang telah jenuh terjadi kesetimbangan antara proses pelarutan dan pembentukan kristal (endapan). Oleh kareana itu, jika kita tambahkan lagi sejumlah zat terlarut, maka akan terjadi pergeseran kesetimbangan ke arah pembentukan endapan, sehingga zat yang kita tambahkan seolah-olah tidak larut.
Kelarutan dari senyawa ion yang mudah larut dalam air biasanya dinyatakan dalam gram per 100 mL. sedangkan kelarutan senyawa ion yang sukar larut dalam air dinyatakan dalam mol/L.
Tetapan Hasil Kelarutan
Secara umum, untuk kesetimbangan kelarutan berikut:
tetapan hasil kali kelarutannya dapat dirumuskan sebgai berikut:
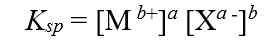
Tetapan hasil kali kelarutan hanya berlaku pada larutan jenuh, dan Ksp tidak mempunyai satuan.
Berikut ini nilai tetapan hasil kali kelarutan beberapa senyawa pada 25⁰C.

Hubungan Antara Kelarutan (s) dan Tetapan Hasil Kelarutan (Ksp)
Secara umum,untuk kesetimbangan kelarutan berikut:

Hubungan tetapan hasil kali kelarutan (Ksp ) dengan kelarutan (s) dapat dirumuskan sebgai berikut:

Pengaruh Ion Senama Terhadap Kelarutan
Agar kalian dapat memahami pengaruh ion senama dalam kelarutan suatu zat maka perhatikan ilustrasi berikut, Apabila kalian mempunyai sebuah keranjang dan 8 bola. Kemudian, kalian akan mengisi keranjang tersebut dengan bola merah hingga keranjang tersebut penuh berisi bola, dan ternyata untuk memenuhi keranjang tersebut diperlukan semua bola merah yang kalian miliki (8 bola merah). Bagaimana jika keadaan awal keranjang tersebut tidak kosong melainkan sudah terdapat 4 buah bola merah di dalamnya? Tentu saja kapasitas dari keranjang telah kalian ketahui maka, kalian tidak dapat menambahkan 8 bola merah yang kalian miliki tetapi kalian hanya dapat memasukan 4 bola merah lagi ke dalam keranjang tersebut.
Jika ke dalam larutan jenuh AgCl ditambahkan beberapa tetes larutan NaCl maka akan segera terjadi pengendapan AgCl. Demikian pula bila ke dalam larutan AgCl tersebut ditambahkan beberapa tetes larutan AgNO3. Hal tersebut dapat dijelaskan dengan mempelajari reaksi kesetimbangan kelarutan AgCl.

Sesuai dengan Asas Le Chatelier, bila ke dalam sistem kesetimbangan tersebut ditambahkan ion Cl- maka kesetimbangan akan bergeser kekiri, sehingga mengakibatkan jumlah AgCl yang mengendap bertambah. Demikian pula bila ke dalam sistem kesetimbangan tersebut ditambahkan ion Ag+, maka sistem kesetimbangan tersebut akan bergeser ke kiri dan berakibat bertambahnya jumlah AgCl yang mengendap. Kesimpulannya bila ke dalam sistem kesetimbangan kelarutan ditambahkan ion senama akan mengakibatkan kelarutan senyawa tersebut berkurang.
Pengaruh pH Terhadap Kelarutan
Tingkat keasaman larutan (pH) dapat mempengaruhi kelarutan suatu zat. Suatu basa umumnya lebih larut dalam larutan yang bersifat asam, dan sebaliknya lebih sukar larut dalam larutan yang bersifat basa. Garam-garam yang berasal dari asam lemah akan lebih mudah larut dalam larutan yang bersifat asam kuat.
Perhatikan persamaan reaksi kesetimbangan Mg(OH)2 berikut :

Ion OH- dalam reaksi tersebut merupakan basa kuat karena ion tersebut adalah basa konjugasi dari asam lemah. Harga Ksp dari reaksi tersebut sangat kecil. Hal ini menunjukkan bahwa kelarutan Mg(OH)2 kecil dalam air.
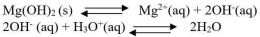
1. Penambahan asam (pH diturunkan)

2. Penambahan basa (pH dinaikkan)

Kenaikan pH berarti penambahan konsentrasi OH- dalam larutan. Jika konsentrasi OH- bertambah reaksi akan bergeser ke arah reaktan, dengan kata lain kelarutan Mg(OH)2 menjadi lebih kecil.
- Kelarutan dari suatu senyawa ionik yang tersusun atas anion dari suatu asam lemah dapat ditingkatkan dengan penambahan asam atau penurunan pH dari larutan.
- Kelarutan dari suatu senyawa ionik yang tersusun atas anion dari suatu asam lemah dapat diturunkan dengan penambahan basa atau menaikkan pH dari larutan.
Senyawa ionik yang tersusun atas anion dari suatu asam kuat memiliki kelarutan dalam asam yang sama dengan kelarutannya dalam air. Hal ini terjadi karena anion dari asam kuat tersebut merupakan basa sangat lemah sehingga penambahan asam tidak akan berpengaruh pada kesetimbangan reaksi akibatnya kelarutan garam tersebut juga tidak berubah.
Reaksi Pengendapan
Kita dapat mengeluarkan suatu ion dari larutannya melalui reaksi pengendapan. Misalnya ion kalsium (Ca2+) dapat dikeluarkan dengan menambahkan larutan Na2CO3. Dalam hal ini, ion Ca2+ akan bergabung dengan ion karbonat (CO32-) membentuk CaCO3, suatu garam yang sukar larut, sehingga mengendap.

Bagaimana proses terbentuknya endapan AgCl ketika larutan NaCl ditetesi dengan larutan AgNO3? Apakah endapan AgCl terbentuk begitu ada ion Ag+yang memasuki larutan? Kita ingat kembali bahwa AgCl dapat larut dalam air, meskipun dalam jumlah yang sangat sedikit. Artinya ion Ag+dan ion Cl- dapat berada bersama-sama dalam larutan hingga larutan jenuh, yaitu sampai hasil kali [Ag+][Cl-] sampai dengan nilai Ksp AgCl. Apabila penambahan ion Ag+ dilanjutkan hingga hasil kali [Ag+][Cl-]> Ksp AgCl, maka kelebihan ion Ag2+ dan ion Cl- akan bergabung membentuk endapan AgCl. Jadi, pada penambahan larutan Ag+ ke dalam larutan Cl- dapat terjadi tiga hal sebagai berikut.
Jika [Ag+] [Cl-] < KspAgCl, larutan belum jenuh
[Ag+] [Cl-] = Ksp AgCl, larutan tepat jenuh
[Ag+] [Cl-] > Ksp AgCl, terbentuk pengendapan
Konsep Ksp dapat digunakan untuk memprediksikan terbentuknya endapan atau tidak pada suatu reaksi. Terbentuknya endapan atau tidak pada akhir proses reaksi tergantung pada molaritas ion-ion dipangkatkan dengan koefisiennya. Hasil kali molaritas awal dari ion-ion dalam larutan, dengan asumsi larutan terionisasi sempurna disebut kuotion reaksi. Kuotion reaksi disimbolkan “Qc”. Jika harga Ksp dan Qc dibandingkan, maka dapat diketahui apakah reaksi kimia membentuk endapan atau tidak.
Untuk mengetahui apa larutan dalam keadaan belum jenuh, tepat jenuh atau terbentuk endapan dapat dilihat dari harga Qc-nya, dengan ketentuan sebagai berikut:
- Qc < Ksp berarti larutan belum jenuh dan belum terbentuk endapan.
- Qc = Ksp berarti larutan tepat jenuh, tetapi belum terbentuk endapan.
- Qc > Ksp berarti larutan lewat jenuh dan terbentuk endapan.
Larutan belum jenuh: larutan yang jumlah zat terlarutnya masih kurang dari jumlah zat maksimum yang dapat larut sehingga belum diperoleh endapan. Larutan jenuh/tepat jenuh: larutan yang jumlah zat terlarutnya maksimum untuk dapat larut sehingga belum diperoleh endapan. Larutan lewat jenuh: larutan yang jumlah zatnya melebihi jumlah maksimum yang dapat larut sehingga terbentuk endapan.