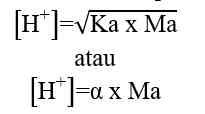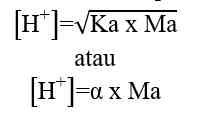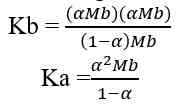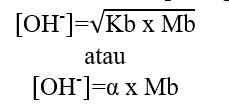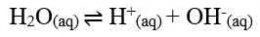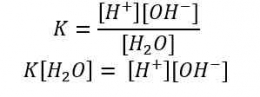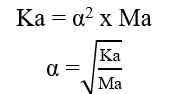Analog dengan di atas maka:
pOH = - log [OH-]
Hubungan antara pH dan pOH adalah sebagai berikut.
Kw = [H+] [OH-]
-log Kw = -log [H+] + (-log [OH-])
Dengan demikian:
pKw = pH + pOH
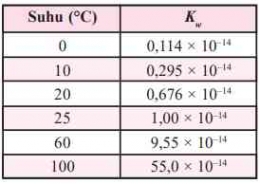
Pada suhu 25oC, pKw = pH + pOH = 14
Berdasarkan uraian di atas dapat disimpulkan bahwa sifat larutan adalah sebagai berikut.
- Netral jika [H+] = [OH-] atau pH = pOH = 7
- Asam jika [H+] > [OH-] atau pH < 7
- Basa jika [H+] < [OH-] atau pH >7
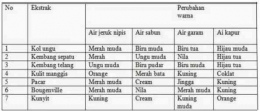
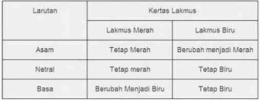
Indikator asam basa
Indikator asam basa merupakan senyawa khusus yang ditambahkan pada larutan dengan tujuan mengetahui kisaran pH dari larutan tersebut. Indikator asam basa akan memberikan warna tertentu apabila direaksikan dengan larutan asam atau basa. Indikator asam basa merupakan senyawa khusus yang ditambahkan pada larutan dengan tujuan mengetahui kisaran pH dari larutan tersebut. Indikator asam basa akan memberikan warna tertentu apabila direaksikan dengan larutan asam atau basa.