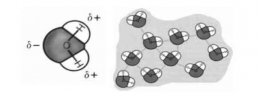
Molekul yang sebaran muatannya tidak simetris, bersifat polar dan memiliki dua ujung yang berbeda muatan (dipol). Molekul zat polar cenderung menyusun diri dengan ujung (pol) positif yang berdekatan dengan ujung (pol) negatif dari molekul didekatnya.
Hal tersebut ditunjukkan melalui ikatan F -- H, O -- H, dan N -- H sangat polar yang disebabkan oleh muatan parsial negatif yang berasal dari pasangan elektron bebas yang dimiliki oleh atom elektronegatif dan atom hidrogen dalam senyawa-senyawa tersebut yang sangat positif.
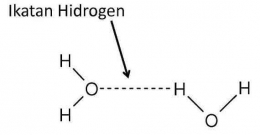
Dengan demikian, adanya perbedaan muatan mengakibatkan atom H dari satu molekul terikat kuat pada atom unsur yang sangat elektronegatif (F, O, atau N) dari molekul tetangganya melalui pasangan elektron bebas pada atom unsur berkeelektronegatifan besar itu, sehingga terjadilah ikatan hidrogen.
Hubungan Interaksi Antar Molekul dengan Sifat Fisik Zat
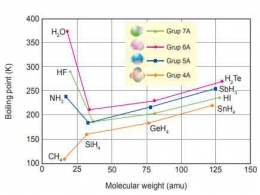
Gaya interaksi antar molekul sangat mempengaruhi sifat fisis zat seperti titik lebur dan titik didih. Ikatan hidrogen sebagai gaya interaksi antar molekul yang paling kuat memberikan pengaruh yang signifikan pada titik didih beberapa senyawa hibrida biner dari unsur golongan IVA sampai VIIA. Berikut merupakan grafik titik didih sebagai fungsi massa molekul senyawa hidrida dari golongan IVA, VA, VIA, dan VIIA sebagai berikut.

Berdasarkan grafik tersebut, perilaku normal ditunjukkan oleh senyawa hidrida dari unsur-unsur golongan IVA (CH4, SiH4, GeH4, dan SnH4, seluruhnya non polar) yaitu titik didih meningkat sesuai dengan penambahan massa molekul. Kecenderungan tersebut juga sesuai dengan yang diharapkan karena massa molekul dari CH ke SnH relatif meningkat, sehingga gaya Van Der Waals juga makin kuat.
Dengan kata lain, hal tersebut dipahami sebagai akibat dari adanya polarisabilitas dan gaya dispersi London yang secara umum meningkat seiring dengan bertambahnya massa molekul.
Senyawa-senyawa hidrida dari golongan VA, VIA, dan VIIA secara umum mengikuti pola kenaikan titik didih yang sama, akan tetapi ada beberapa pengecualian seperti yang terlihat pada grafik, yaitu HF, H2O, dan NH3. Ketiga senyawa tersebut memiliki titik didih yang luar biasa tinggi dibandingkan anggota lain dalam kelompoknya.
Hal tersebut menunjukkan bahwa ketiga senyawa tersebut memiliki sifat-sifat yang membedakannya dari senyawa-senyawa lain dengan massa molekul dan polaritas yang bermiripan. Sebagai contoh, sifat dari molekul air (H2O) yang memiliki titik leleh, kalor jenis, dan kalor penguapan yang tinggi, dimana sifat-sifat tersebut menunjukkan adanya gaya antar molekul tak lazim yang kuat pada ketiga molekul tersebut yang disebut ikatan hidrogen.
Keleektronegatifan pada atom F, O, dan N yang cukup tinggi menyebabkan adanya interaksi antar molekul yang jauh lebih kuat dengan konfigurasi energi yang sangat rendah (sangat stabil), berbeda dengan senyawa-senyawa lainnya yang hanya terbentuk melalui ikatan Van Der Waals. Kestabilan inilah untuk dilebur atau dididihkan memerlukan energi yang lebih besar, sehingga ketiga senyawa tersebut memiliki titik didih yang lebih besar. Dari penjelasan tersebut, dapat disimpulkan bahwa ikatan hidrogen dapat berpengaruh terhadap sifat fisis suatu zat seperti kenaikan titik didih dibandingkan dengan peramalan berdasarkan berat molekul.