Pernahkah anda berpikir hidup tanpa baterai? Pasti akan sangat menyulitkan bukan? Jika dipikir-pikir, kehidupan kita banyak sekali terbantu dengan ditemukannya baterai sebagai sumber energi portable yang sangat banyak kegunaannya.
Banyak perkakas rumah tangga dan peralatan kerja kita yang menggunakan baterai. Dari peralatan yang sederhana sampai peralatan yang canggih semua menggunakan baterai. Baterai membuat peralatan elektronik bisa digunakan tanpa harus disambungkan ke sumber listrik.
Sel Volta
Mari kita sedikit mempelajari sejarah ditemukannya baterai. Ditemukannya baterai dimulai ketika ilmuwan Italia Luigi Galvani menemukan bahwa otot katak berkontraksi ketika disentuh dengan logam pada tahun 1791.
Kemudian, Alessandro Volta yang memang tertarik meneliti tentang listrik mengambil inspirasi dari eksperimen itu. Volta melakukan serangkaian eksperimen dengan menggunakan seng, timbal, timah atau besi sebagai plat positif dan tembaga, perak, emas atau grafit sebagai plat negatif.
Pada tahun 1800, Volta menemukan bahwa dengan menggunakan larutan tertentu sebagai konduktor untuk mendorong reaksi antara logam dan elektroda, arus listrik terus menerus dapat dihasilkan. Hal ini menjadi awal penemuan sel volta yang lebih dikenal sebagai baterai.
Sel volta adalah salah satu sel elektrokimia yang berbasis pada reaksi reduksi-oksidasi (redoks) yang terjadi pada unsur. Reaksi redoks dapat menyebabkan terjadinya aliran elektron yang menyebabkan munculnya arus listrik.
Secara sederhana, sel elektrokimia bisa diklasifikasikan menjadi dua, yaitu sel volta dan sel elektrolisis. Sel volta adalah sel yang menghasilkan listrik sedangkan sel elektrolisis adalah sel yang memerlukan listrik untuk bisa bekerja. Sel volta menghasilkan listrik disebabkan karena adanya reaksi redoks yang terjadi secara spontan.
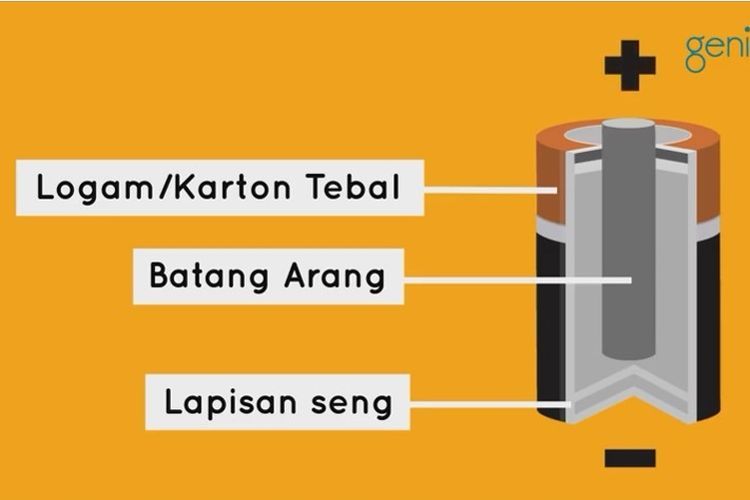
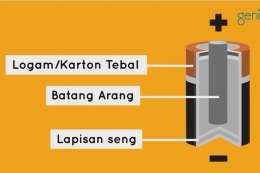
Pada rangkaian sel volta terdapat dua elektroda yang berfungsi sebagai elektroda positif dan elektroda negatif. Elektroda negatif diberi nama anoda dan elektroda positif diberi nama katoda.
Pada anoda terjadi reaksi oksidasi yang bisa mengeluarkan elektron. Elektron yang dikeluarkan akan menuju katoda untuk ditangkap sehingga terjadi reaksi reduksi pada elektroda tersebut.
Untuk bisa terjadi reaksi redoks secara spontan dan menghasilkan tegangan, unsur yang dipasangkan sebagai elektroda positif dan negatif harus sesuai. Nilai potensial elektroda unsur di katoda harus lebih besar daripada nilai potensial elektroda unsur di anoda. Perbedaan potensial inilah yang menghasilkan tegangan.